4/3. Как выделить микроорганизмы, разрушающие целлюлозу?
2019, Валерий Зайцев. Это произведение доступно по лицензии Creative Commons Attribution-NonCommercial («Атрибуция — Некоммерческое использование») 4.0 Всемирная
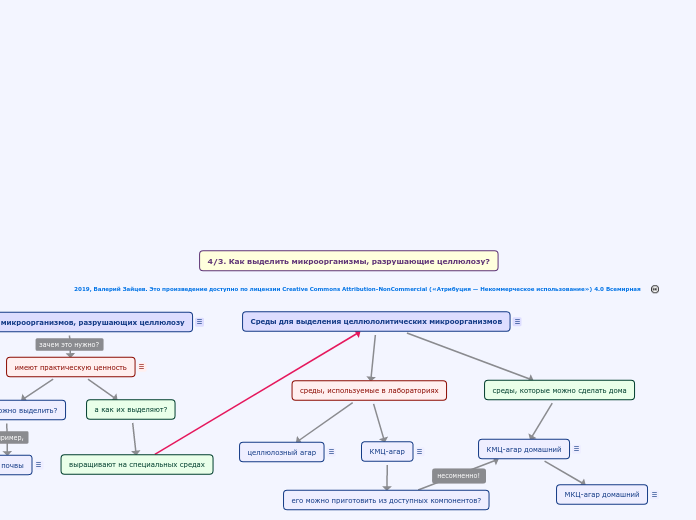
Выделение микроорганизмов, разрушающих целлюлозу
Такие микроорганизмы называют «целлюлозолитическими» или «целлюлолитическими»
имеют практическую ценность
Целлюлюза является одним из главных полимеров в составе растений. Она практически нерастворима в воде, поэтому при различных видах использования растительного сырья попадает в отходы. В то же время, целлюлоза - полисахарид (углевод), что делает заманчивым её биотехнологическое использование - например, превращение в биотопливо. Этого можно добиться либо используя микроорганизмы, которые превращают целлюлозу в полезные человеку продукты, либо расщепляя целлюлозу до глюкозы (а уж глюкозу мы умеем использовать самыми разными способами). Для расщепления целлюлозы нужны источники соответствующего фермента целлюлазы - а это опять-таки микроорганизмы.Про микробные целлюлазы можно почитать, например, в статьеБикаша Бехеры с соавторами (2017)илиШанкара Гаутамы с соавторами (2012)
aоткуда их можно выделить?
из почвы
лесная почва обычно подходит лучше, чем, например, луговая - деревья в лесу приносят в почву больше целлюлозы, а значит, и организмов, способных её разрушать, там тоже может быть больше
а как их выделяют?
выращивают на специальных средах
Среды для выделения целлюлолитических микроорганизмов
Эти среды должны обладать одновременно двумя важными свойствами:обеспечивать устойчивый рост микробов, для которых единственным источником углерода может служить целлюлоза;подавлять рост микробов, не способных использовать целлюлозу.Поэтому такие среды обычно достаточно бедны питательными веществами, а в качестве единственного органического питательного вещества используется целлюлоза или некоторые её производные, например, карбоксиметилцеллюлоза (КМЦ).Для первичного выделения целлюлолитических микробов почти всегда использую твердые, а не жидкие питательные (ростовые, культуральные) среды.
среды, используемые в лабораториях
целлюлозный агар
Классическая питательная среда. В последнее время чаще всего используется вариант среды, предложенный в 1995 годуХендриксом с соавторами:На 1 литр среды требуется 0,5 г K2HPO4, 0,25 г MgSO4, 1,88 г обеззоленного и промытого кислотой целлюлозного порошка, 0,2 г красителя конго красного, 5 г агар и 2 г желатина; рН среды должен быть равен 7,0 до добавления агара и желатина.Целлюлозный порошок может быть заменен микрокристаллической целлюлозой (размер 20 мкм). Простейшая среда будет иметь состав (на 1 л): 0,5 г K2HPO4, 0,25 г MgSO4, 1,88 г микрокристаллической целлюлозы и 20 г агара.
КМЦ-агар
Пожалуй, наиболее широко используемая питательная среды для выделения целлюлолитических микроорганизмов.Существует множество вариантов среды в зависимости от задач, для которых она используется. Во многих случаях КМЦ просто заменяют целлюлозный порошок, не изменяя содержания остальных компонентов. Так, например, поступилиИслам и Рой, заменив в среде Хендрикса (целлюлозный агар) целлюлозный порошок на КМЦ.Другой вариант КМЦ-агара [Samira et al., 2011] содержит на 1 л среды: 1 г KH2PO4, 0,5 г MgSO4х7H2O, 0,5 г NaCl, 0,01 г FeSO4х7H2O, 0,01 г MnSO4хH2O, 0,3 г NH4NO3, 10 г КМЦ и 12 г агара.Если нужно выделять только целлюлолитические бактерии, в среду добавляют какой-нибудь противогрибковый антибиотик до концентрации 100 мг/л среды. Для более селективного выращивания грибов обычно повышают концентрацию солей в питательной среде (например, см.здесь) и добавляют антибактериальный антибиотик (например, хлорамфеникол до концентрации 50 мг/л).
aего можно приготовить из доступных компонентов?
среды, которые можно сделать дома
КМЦ-агар домашний
В составе КМЦ-агара при домашнем приготовлении можно использовать порошок КМЦ, продающийся в качестве пищевой добавки Е466. Желатин можно использовать пищевой. Также пищевой агар-агар (желирующий агент в кулинарии) можно взять вместо микробиологического агара. Краситель исключается, а соли в РФ легко купить в одном из интернет-магазинов химических реактивов.Один из вариантов КМЦ-агара можно приготовить так. В 900 мл теплой воды добавить 0,5 г KH2PO4 и 0,5 г MgSO4х7H2O, размешать до полного растворения, проверить величину рН (например, ручным рН-метром или рН-метром для аквариума), если необходимо - довести рН до величины 7,0 раствором щелочи (можно использовать, например, самые дешевые средства для промывки канализационных труб - они обычно представляют собой просто раствор NaOH в воде). После этого добавить 10 г КМЦ, размешать до полного растворения при умеренном нагревании. Затем добавить 12 г агар-агара и нагревать на водяной бане до полного растворения. После получения раствора без комочков останется стерилизовать среду любым подходящим способом и разлить её (пока она еще горячая) в чашки Петри или другую подходящую посуду, которую вы соберетесь использовать для выращивания микроорганизмов (разливать в стерильных условиях!).
МКЦ-агар домашний
МКЦ-агар по домашнему рецепту готовится так же, как и КМЦ-агар, но КМЦ заменяется на порошок микрокристаллической целлюлозы (МКЦ), который может быть приобретен как пищевая добавка E460i или получен из соответствующих БАД (лучше из капсул или из таблеток, не содержащих солей стеариновой кислоты)
Лабораторная работа 4/3
результаты обучения
развиваемые навыки
приготовление микробиологических питательных средвыращивание микроорганизмов из образцов из окружающей средыработа в стерильных условиях
вопросы для обсуждения
Какие вещества или материалы могут служить субстратами для скрининга микроорганизмов на наличие целлюлолитической активности?Какой субстрат - КМЦ или МКЦ - лучше подходит для выявления целлюлолитических микроорганизмов?Что важнее при скрининге целлюлолитических микроорганизмов - бóльшее разнообразие выделенных организмов или более высокая способность к деградации целлюлозы?Откуда лучше брать образцы материала для скрининга целлюлолитиков?
лабораторные протоколы
организация работы
Подготовительная часть (преподаватель + лаборант): подготовка необходимых материалов и оборудования; если используются стеклянные чашки Петри (или их аналоги) - их стерилизация не менее чем за сутки до занятия.Подготовительная часть (студенты): взять в природной среде образцы почвы из расчета 1 образец на двух студентов; образцы отобрать не менее чем за 5 дней до даты занятия 4, массой не менее 100 г (во влажном состоянии), высушить до воздушно-сухого состояния, избегая прямого солнечного света. Образцы почвы не должны содержать каких-либо растительных остатков. Весьма желательно, чтобы образцы почвы были собраны из максимально разнообразных ценозов. Образцы собираются из расчета 1 образец на 2 студентов.Основная часть (студенты на занятии): группа делится на две подгруппы - одна подгруппа готовит чашки с КМЦ-агаром, вторая - с МКЦ-агаром из расчета 1 чашка на каждого студента. Вместо фабричных чашек Петри можно использовать их аналоги из подручной посуды. Для подготовки образца и нанесения его на чашки студенты объединяются во временные пары (по одному студенту из подгруппы 1 и из подгруппы 2).Последующая часть (лаборант): инкубация чашек Петри (или их альтернативы) с питательной средой, инокулированных образцами, в термостате (25°С) с проверкой роста 2 раза в день. При достижении целевого уровня роста (числа и размера колоний; определяется преподавателем) чашки переносятся из термостата в холодильник (+4°С) и сохраняются там до дня занятия 5. За 1 час до начала занятия чашки переносятся из холодильника в термостат (25°С).Важно! Поскольку студенты работают с разными условиями экспериментов преподавателю следует обеспечить студентам возможность ознакомиться с результатами друг друга. Делать это в ходе выполнения эксперимента или во время заключительного мини-коллоквиума занятия - выбор преподавателя.
4/3 а. Приготовление КМЦ-агара
Протокол выполнения опытадля приготовления 200 мл среды (*количество и объемы указаны для заливки 8 чашек Петри диаметром 9 см) подогреть 180 мл воды до температуры 35-45°С;взвесить 0,1 г безводного однозамещенного фосфата калия (KH2PO4) и 0,1 г сульфата магния (MgSO4 x 7 H2O);размешать до полного растворения;используя ручной рН-метр, проверить величину рН полученного раствора;если величина рН не равна 7,00±0,05, довести её до необходимой титрованием раствором NaOH или KOH;добавить к полученному раствору 10 г КМЦ, размешать до полного растворения на магнитной мешалке, при необходимости немного подогревая раствор;добавить 2,5 г агар-агара, перенести на водяную баню и нагревать до полного растворения;полученную среду без комочков перелить в стеклянную бутыль со слегка незакрученной резьбовой крышкой и стерилизовать в микроволновой печи в течение 10 мин на мощности 700 Вт;стерилизованную среду немного охладить (не ниже 75°С) и разлить в чашки Петри (или заменяющую их посуду) в стерильных условиях (например, в ламинарном шкафу);после остывания до комнатной температуры чашки со средой можно использовать для инокуляции микроорганизмами.
4/3 б. Приготовление МКЦ-агара
Протокол выполнения опытадля приготовления 200 мл среды (*количество и объемы указаны для заливки 8 чашек Петри диаметром 9 см) подогреть 180 мл воды до температуры 35-45°С;взвесить 0,1 г безводного однозамещенного фосфата калия (KH2PO4) и 0,1 г сульфата магния (MgSO4 x 7 H2O);размешать до полного растворения;используя ручной рН-метр, проверить величину рН полученного раствора;если величина рН не равна 7,00±0,05, довести её до необходимой титрованием раствором NaOH или KOH;добавить к полученному раствору 10 г МКЦ, хорошо суспендировать;добавить 2,5 г агар-агара, перенести на водяную баню и нагревать до полного растворения;полученную среду без комочков перелить в стеклянную бутыль со слегка незакрученной резьбовой крышкой и стерилизовать в микроволновой печи в течение 10 мин на мощности 700 Вт;стерилизованную среду немного охладить (не ниже 75°С) и разлить в чашки Петри (или заменяющую их посуду) в стерильных условиях (например, в ламинарном шкафу);после остывания до комнатной температуры чашки со средой можно использовать для инокуляции микроорганизмами.
4/3 в. Инокуляция среды образцами для скрининга
Протокол выполнения опытаОбразцы для скрининга: образцы почвы, собранные каждым студентом на различных территориях. Образцы собираются из расчета 1 образец на пару студентов. Один студент из пары, работающей с определенным образцом, должен приготовить чашку Петри с КМЦ-агаром (протокол 4/3 а), второй - чашку Петри с МКЦ-агаром (протокол 4/3 б).Взятие и предварительная подготовка образца (выполняется студентами во внеаудиторное время до занятия 4)в выбранной локализации взять образец почвы массой не менее 100 г во влажном состоянии не менее чем за 5 дней до даты занятия 4;удалить из образцов почвы все растительные остатки;высушить образцы до воздушно-сухого состояния, избегая прямого солнечного света;измельчить высушенные образцы почвы и просеять через сито с размером ячеек 2 мм;после высушивания и просеивания еще раз проверить образцы на отсутствие растительных остатков (удалить, если что-то найдется).Нанесение образцов на чашки для культивированиявзвесьте 10 г воздушно-сухого, измельченного и просеянного образца почвы;суспендируйте почву в 90 мл стерильной воды (таким образом получается суспензия почвы с разведением 1/10);сразу после взбалтывания (не допуская осаждения частиц) отберите 1 мл суспензии 1/10 и смешайте с 9 мл стерильной воды (получается суспензия почвы с разведением 1/100);повторяя несколько раз операцию из п.3 получите суспензию с разведением 1/100000);отберите 0,1 мл суспензии с разведением 1/100000 и в стерильных условиях равномерно распределите по поверхности КМЦ-агара или МКЦ-агара в чашке Петри);поставьте необходимые пометки на крышке чашки Петри и закройте её;передайте чашки Петри, инокулированые образцами почвы, лаборанту для инкубации до занятия 5.
оформление результатов
для всех протоколов - описательное
В свободной форме, содержащей:рабочие протоколы выполнения работы,фотографии поэтапного выполнения протоколов.
Для чтения
Ashwani e.a. 2014
Ashwani K., Saida L., Reddy K.V. Isolation, screening and characterization of cellulolytic bacteria from forest soil sample. Int. J. Curr. Microbiol. Appl. Sci. 2014; 3(10): 679-685.
a