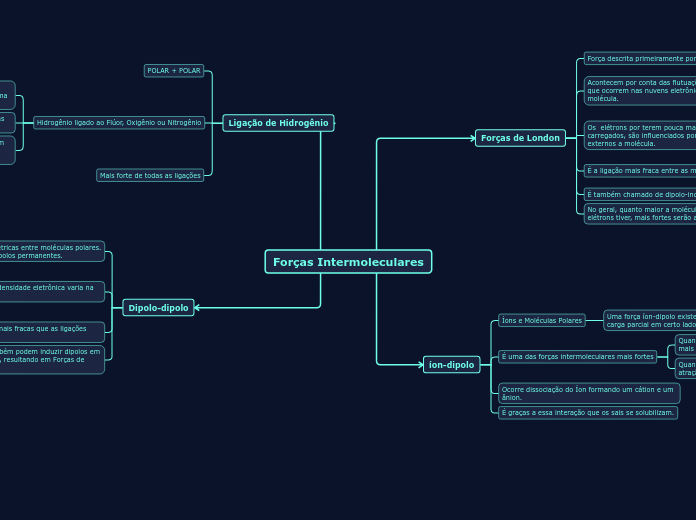
Forças Intermoleculares
Forças de London
Força descrita primeiramente por Fritz London
1930
Acontecem por conta das flutuações momentâneas que ocorrem nas nuvens eletrônicas em uma molécula.
APOLAR + APOLAR
Ou seja, em um instante, podemos encontrar mais
elétrons em uma extremidade da molécula que em outra.
Sempre que essa oscilação ocorre
há uma assimetria momentânea da carga
Isso produz um dipolo
Os elétrons por terem pouca massa e serem carregados, são influenciados por campos elétricos externos a molécula.
Quando uma molécula encontra outra nesse momento dipolar, ela sofre o que chamados de força coulombica repulsiva, o que provoca um deslocamento temporário dos elétrons.
Esse comportamento tenderá
a repelir os elétrons da partícula
vizinha, convertendo-a em um dipolo
temporário
É a ligação mais fraca entre as moléculas
Pois a polaridade gerada pela primeira partícula é momentânea e isso induz uma polaridade similar na segunda partícula.
O resultado é uma fraca atração entre as moléculas
É também chamado de dipolo-induzido
No geral, quanto maior a molécula e quanto mais elétrons tiver, mais fortes serão as forças de London.
íon-dipolo
Íons e Moléculas Polares
Uma força íon-dipolo existe entre um íon e a
carga parcial em certo lado de uma molécula polar.
É uma das forças intermoleculares mais fortes
Quanto menor a distância entre o íon e o dipolo, mais forte será a atração.
Quanto maior a carga do íon, mais forte será a atração.
Ocorre dissociação do Íon formando um cátion e um ânion.
É graças a essa interação que os sais se solubilizam.
Ligação de Hidrogênio
POLAR + POLAR
Hidrogênio ligado ao Flúor, Oxigênio ou Nitrogênio
F, O e N são átomos altamente eletronegativos
Ao atrair o elétron do Hidrogênio, o H receberá uma carga parcial positiva
Essa carga ficará "exposta" especialmente a outras moléculas
Se um átomo com uma carga pacial negativa e um par de elétrons solitário disponível se aproxima dessa carga positiva exposta.
O resultado será uma forte atração baseada em dipolo.
Mais forte de todas as ligações
Dipolo-dipolo
São atrações elétricas entre moléculas polares.
Ou seja, com dipolos permanentes.
POLAR + POLAR
São dipolos porque a densidade eletrônica varia na partícula.
Ou seja, haverão regiões na partícula que
serão mais eletronegativas e regiões mais
eletropositivas.
Esses polos atraem outros
polos opostos de outras partículas
Em resumo, os terminais das moléculas carregadas com sinais opostos são induzidos a se manterem próximos um do outro
São geralmente bem mais fracas que as ligações iônicas ou covalentes.
Moléculas polares também podem induzir dipolos em moléculas não polares, resultando em Forças de London