LOS MODELOS ATÓMICOS
EDAD ANTIGUA

LEUCIPIO
POSTULA QUE
EXISTE UN SOLO TIPO DE MATERIA
LA MATERIA TIENE QUE LLEGAR A UN PUNTO INDIVISIBLE

DEMÓCRITO
POSTULA QUE
LOS ÁTOMOS
SON
ETERNOS
INDIVISIBLES
HOMOGÉNEOS
INVISIBLES
SE DIFERENCIAN EN
FORMA
TAMAÑO
AFECTAN EN
LAS PROPIEDADES DE LA MATERIA

EMPÉDOCLES
POSTULA QUE
LA MATERIA
ESTA COMPUESTA POR
TIERRA
AIRE
AGUA
FUEGO

ARISTÓTELES
ACEPTA LOS POSTULADOS DE
EMPÉDOCLES
REFERENTES A
LOS COMPONENTES DE LA MATERIA
REFUTA LA IDEA DEL
ÁTOMO
MODERNIDAD

DALTON

TEORÍA ATÓMICA 1808
RETOMA LAS IDEAS DE
LEUCIPIO Y DEMÓCRITO
POSTULADOS
LOS ELEMENTOS
ESTÁN FORMADOS POR
PARTICULAS
DIMINUTAS
INDIVISIBLES
ÁTOMOS
INALTERABLES
SISTEMA PARA DESIGNAR A CADA ÁTOMO
LOS ÁTOMOS
DE
UN MISMO ELEMENTO
IGUALES EN
FORMA
TAMAÑO
PROPIEDADES FÍSICAS Y QUÍMICAS
LOS COMPUESTOS SE FORMAN POR
LA UNIÓN DE LOS ELEMENTOS CORRESPONDIENTES
SEGÚN
UNA RELACIÓN NUMÉRICA
SENCILLA
CONSTANTE
SIGLO XXI
SON
REPRESENTACIONES ESTRUCTURALES DE UN ÁTOMO AVANZADAS

LEWIS
MODELO ÁTOMICO 1902
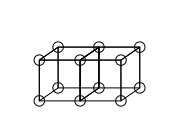
ÁTOMO
PRESENTADO COMO
UN CUBO
CON
ELECTRONES
EN
SUS VÉRTICES
Subtema
INTRODUCE EL CONCEPTO DE
VALENCIA DE UN ÁTOMO
CANTIDAD DE ELECTRONES
DEL
ÚLTIMO NIVEL DE ENERGÍA

THOMSON
MODELO ÁTOMICO 1906
UNA ESFERA NEUTRA
CON
ELECTRONES INMERSOS EN ELLA

CARACTERÍSTICAS
LA CARGA
POSITIVA
NEGATIVA
ES IGUAL
POR LO TANTO
UN ÁTOMO NO TIENE CARGA
NO TIENE
NÚCLEO ATÓMICO
DESCUBRE
LA PRIMERA PARTÍCULA SUBATÓMICA
EL ELECTRÓN
MEDIANTE
UN EXPERIMENTO
DE
TUBOS CATÓDICOS

PERRIN
PROPONE
UN CAMBIO CON RESPECTO A
EL MODELO ATÓMICO DE THOMSON
SUGIRIENDO QUE
LOS ELECTRONES
SE ENCUENTRAN
EN EL EXTERIOR DE EL ÁTOMO

RUTHERFORD
MODELO ATÓMICO 1911
CARACTERÍSTICAS
EL ÁTOMO
CONSTA DE UN NÚCLEO CENTRAL
DONDE
SE CONCENTRA
LA CARGA POSITIVA
CASI TODA LA MASA
ELECTRONES
QUE SE SITUAN EN
LA CORTEZA
DESCRIBIENDO
ORBITAS CIRCULARES
QUE
GIRAN A GRAN VELOCIDAD
CONOCIDO COMO
MODELO PLANETARIO
REALIZA

EL EXPERIMENTO DE LA LAMINA DE ORO

BOHR
MODELO ATÓMICO 1913
INCORPORA LA IDEA DE
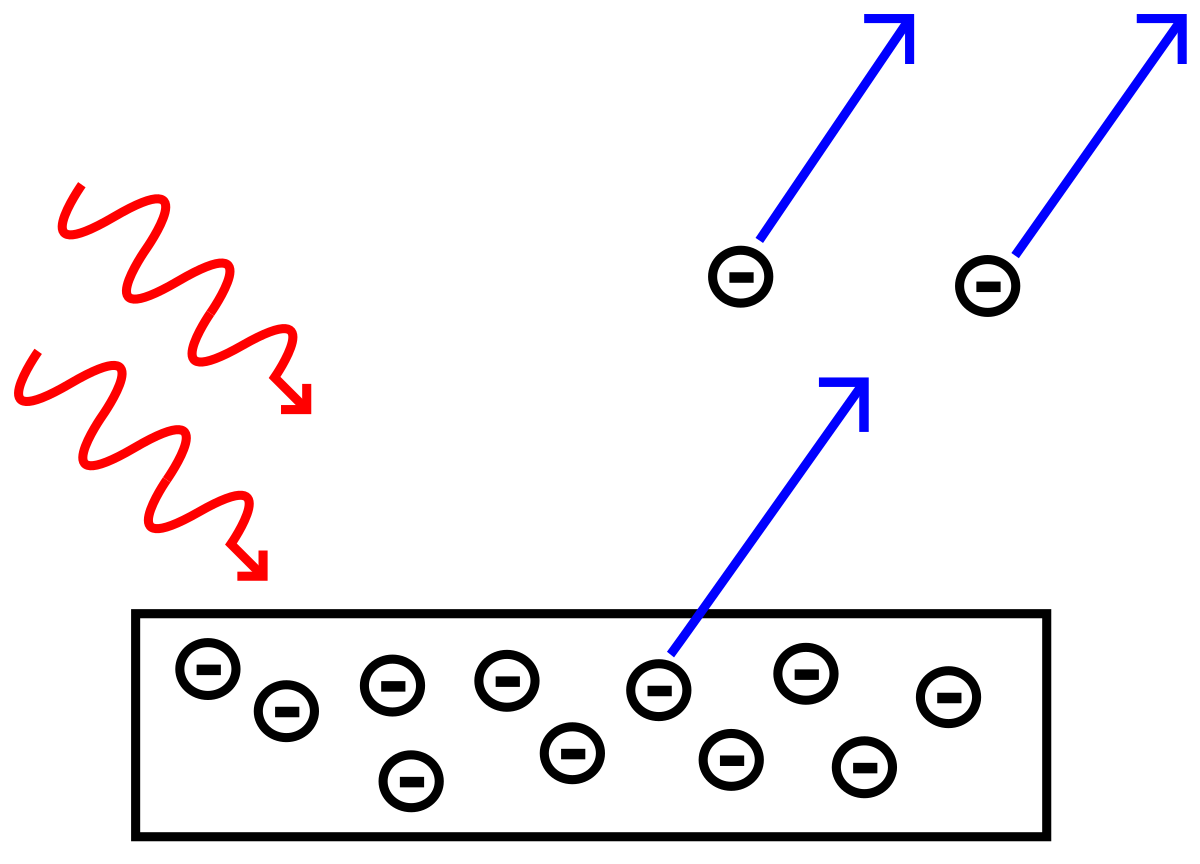
EFECTO FOTOELÉCTRICO
POSTULADOS
EL ELECTRÓN
SOLO PUEDE MOVERSE A CIERTA DISTANCIA DEL ÁTOMO
MIENTRAS SE ENCUENTRE EN UNA ÓRBITA
NO LIBERA NI ABSORBE ENERGÍA
CUANDO SE LE ENTREGA ENERGÍA A UN ÁTOMO
PUEDE ABSORBERLA
Y
PASAR A UNA ORBITA DE MAYOR RADIO
POR LO QUE ESTÁ
CUANDO UN ELECTRÓN PASA
DE
UNA ORBITA MÁS ALEJADA DEL NUECLEO
A
UNA MÁS CERCANA
LIBERA ENERGÍA
Subtema
PARA PASAR DE UNA ORBITA A OTRA
ABSORBER
UNA CANTIDAD DE ENERGÍA
IGUAL A
LA DIFERENCIA DE ENERGÍA
ENTRE
UN NIVEL Y OTRO
EMITIR

SOMMERFELD
MODELO ATÓMICO 1916
BASADO EN
LA TEORÍA DE LA RELATIVIDAD DE

EINSTEIN
Subtopic
POSTULADOS
LOS ELECTRONES
SE MUEVEN ALREDEDOR DE
EL NÚCLEO
EN
ORBITAS
CIRCULARES
ELÍPTICAS
EL CENTRO DE MASAS DEL SISTEMA

A PARTIR DEL
SEGUNDO NIVEL ENERGÉTICO
EXITEN
2 O MÁS SUBNIVELES
EN
EL MISMO NIVEL
EL ELECTRÓN
ES
UNA CORRIENTE ELÉCTRICA MINÚSCULA


SCHRODINGER
MODELO ATÓMICO 1926

CUÁNTICO
NO RELATIVISTA
CARACTERÍSTICAS
DESCRIBE
EL MOVIMIENTO DE LOS ELECTRONES
COMO
ONDAS ESTACIONARIAS
LOS ELECTRONES
SE MUEVEN CONSTANTEMENTE
ESTABLECE
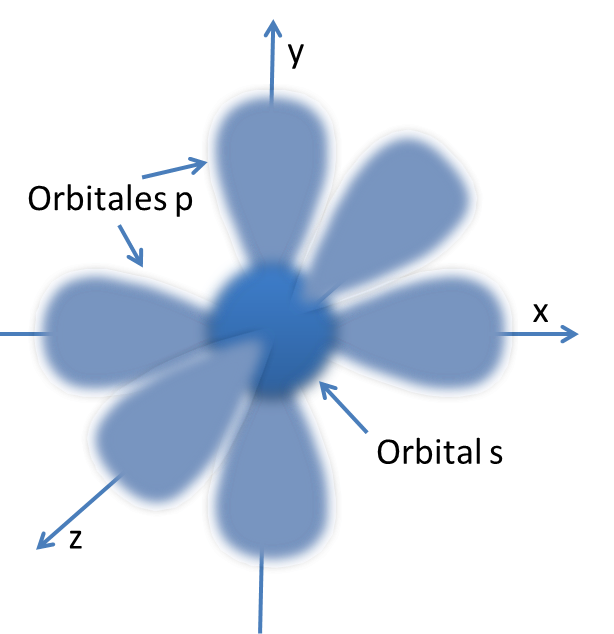
UNA ZONA DE PROBABILIDAD PARA UBICAR EL ELECTRÓN
ORBITALES ATÓMICOS
QUE CUENTAN CON
NIVELES
SUBNIVELES
DE
ENERGÍA

MODELO ATÓMICO ACTUAL
BROGLIE, EINSTEIN, BOHR, SCHRODINGER
BASADO EN
MECÁNICA CUÁNTICA ONDULATORIA
POSTULADOS
EN LOS ÁTOMOS
LOS ELECTRONES
ESTÁN DISTRIBUIDOS EN
NIVELES DE ENERGÍA
ESTACIONARIA
FIJA
LOS ELECTRONES SE MUEVEN ALREDEDOR DEL NÚCLEO
SIN
PERDER
GANAR
ENERGÍA
EL NIVEL DE ENERGÍA
ESTÁ FORMADO POR
IGUAL NÚMERO DE SUBNIVELES
EL SUBNIVEL DE ENERGÍA
CONSTA DE
UNO O MÁS
ORBITALES
NUBES ELECTRÓNICAS
UN ORBITAL
SE LLENA CON
DOS ELECTRONES
CON
ROTACIÓN CONTRARIA



ECUACIÓN DE ONDA DE SCHRODINGER

SON
REPRESENTACIONES MENTALES
DE
LA ESTRUCTURA
EL FUNCIONAMIENTO
DE LOS
ÁTOMOS