Materia, Estructura y Periodicidad
1.1. Materia: Estructura, composición, estados
de agregación y clasificación por
propiedades.
La materia es todo lo que tiene masa y ocupa un lugar en el espacio llamada volumen, por que todo cuerpo ocupa un lugar en el espacio.
Propiedades del cuerpo
Masa
Peso
Volumen
Volumen de un objeto es el espacio que ocupa.
El peso equivale a la fuerza que ejerce un cuerpo sobre un punto de apoyo, originada por la acción del campo gravitatorio local sobre la masa del cuerpo
Masa de un cuerpo está relacionada con el número y clase de partículas que lo forman.
Propiedades de la materia
Fisica
Quimica
Intensivas
Extensivas
Varian con la cantidad de sustancia
Peso, volumen, largo, ancho, masa, altura
Varian con la cantidad suficiente de sustancia
Color, punto de ebullicion, punto de fusion, densidad
Capacidad de una sustancia para transformarse en otra
Combustion del carbon,reaccion de hidrogeno y el oxigeno para producir agua
Azucar es un ejemplo de cambio quimico, ya que se calienta y se hace caramelo y se llega a carbonizar, ya no regresa a su estado, se crean otros compuestos.
Alteran la identidad de la materia
Color,estado fisico,masa,peso,volumen,punto de ebullición
El agua es un ejemplo de cambio fisico, ya que se puede estar en los 3 estados fisicos
Dilatabilidad
Dilatación es el aumento de volumen, generalmente imperceptible, de un cuerpo durante la elevación de su temperatura a presión constante.
Impenetrabilidad
La propiedad de la materia de tener su propio espacio en un tiempo y lugar determinado
Estados de agregación o estados físicos.
Solido
liquido
Gaseoso
De agregación de la materia compuesto principalmente por moléculas no unidas, expandidas y con poca fuerza de atracción
El íquido es un estado de agregación de la materia en forma de fluido altamente incompresible, lo que significa que su volumen es casi constante en un rango grande de presión.
Sólido es un estado de agregación de la materia, que se caracteriza porque opone resistencia a cambios de forma y de volumen. Sus partículas se encuentran juntas y también se ven correctamente ordenadas.
Independientemente de su estado físico, toda materia
Mezcla materia heterogénea compuesta por dos o mas sustancias puras , cada una de las cuales conserva su identidad y sus propiedades especificas .
Homogénia materia que es uniforme en su composición y propiedades en totalidad de la muestra.
Heterogénea no es uniforme con su composición ni en sus propiedades consta con dos o más porciones o fases fisicamente distintas y distribuidas de manera irregular.

Subtopic
1.2. Sustancias puras: elementos y compuestos.
Sustancia pura , caracterizada por su composición definida y costante y por tener propiedades definidas y costantes bajo una serie de condiciones detérminadas, Las sustancias puras se dividen en dos grupos
Elementos cualquier sustancia pura que no se puede descomponer por medio de químicos ordinarios en dos o más sustancias diferentes y más simples.
El oro, el aluminio, el hidrógeno, el oxígeno, el sodio, el cloro, el carbono y el mercurio son elementos.
A su vez, los elementos están compuestos por átomos. Los átomos son las “piezas” más pequeñas de un elemento que pueden existir y sin dejar de ser ese elemento.
Compuestos cualquier sustancia pura que se puede descomponer por medios quimicos en dos o mas sustancias diferentes y mas simples.
La aplicación de una corriente eléctrica puede hacer que el agua se separe en hidrógeno y oxígeno y la sal en sodio y cloro.
Transformación
Punto de ebullición.- El punto de ebullición de un elemento o compuesto significa la temperatura a la cuambia la forma líquida de un elemento o compuesto se encuentra en equilibrio con la forma gaseosa.
Punto de fusión.- El punto de fusión de un elemento o compuesto es la temperatura a la cual la forma sólida del elemento o compuesto se encuentra en equilibrio con la forma líquida.
Ejemplo de solido con bajo punto de fusion , es el fenol es un solido cristalino que se funde a 43c , arriba de este valor de temperatura , se convierte el liquido pero sigue siendo fenol
1.3. Dispersiones o mezclas.
El mundo natural, la materia usualmente se encuentra en forma de mezclas, casi todos los gases, líquidos y sólidos de los cuales está formado el mundo son mezclas de dos o más sustancias juntas, mezcladas de forma física y no químicamente combinadas.
Tipos de mezclas
Sinteticas ejemplos
Las sintéticas como el vidrio o el jabón , que contienen pocos componentes
Naturales
Las naturales como el agua de mar o el suelo que son complejas ya que contienen más de 50 sustancias diferentes.
Vivientes
Mezcla más maravillosa es la célula, una bacteria sencilla contiene más de 5000 compuestos diferentes, todos en armonía formando un sistema altamente organizado que sostiene a la vida.
Ejemplos de solidos cristalinos, silicio, germanio, galio
1.4. Caracterización de los estados de
agregación: sólido cristalino, líquido,
sólido, vítreo y gel.
En el estado sólido, las moléculas, átomos o iones que componen la sustancia considerada estan unidas entre si las cuales tambien estan mas compactadas de tal manera que no hay huecos entre ellos asi no dando margen de fricción.
Característica importante de la mayoría de los sólidos es su estructura cristalina. Los átomos están distribuidos en posiciones regulares que se repiten regularmente de manera geométrica.
Estado liquido, Las moléculas que constituyen las materias se atraen entre sí mediante fuerzas de intensidad variable,Un líquido es un fluido que mana bajo la acción de fuerzas débiles y que se adapta a la forma que lo contiene.
Moleculas se mueven sin ningun orden.
Estado vítreo es amorfo, caracterizado por la rápida ordenación de las moléculas para obtener posiciones definidas. Los cuerpos en estado vítreo se caracterizan por presentar un aspecto sólido con cierta dureza y rigidez y que ante esfuerzos externos moderados se deforman de manera generalmente elástica
El estado de gel es la resistencia de un líquido a fluir libremente.
Propiedades: Los geles presentan una densidad similar a los líquidos, sin embargo su estructura se asemeja más a la de un sólido. Ciertos geles presentan la capacidad de pasar de un estado coloidal a otro, es decir, permanecen fluidos cuando son agitados y se solidifican cuando permanecen inmóviles.
Esta característica se denomina tixotropía.
El proceso por el cual se forma un gel se denomina gelación.
Ejemplo: esta la mantequilla amarilla, el vidrio y la gelatina común.
1.5. Cambios de estado.
Nuestro medio ambiente y bajo ciertas condiciones, las substancias se presentan en uno de los estados de agregación antes mencionados, pero pueden cambiar de un estado a otro si las condiciones cambian. Estas condiciones son presión y temperatura.
Fusión: cambio que sufren las sustancias al pasar del estado sólido al líquido al incrementar el calor
Evaporación: Cambio que se experimenta cuando un líquido pasa al estado de vapor o gas por incremento de calor.
Sublimación: Es el paso del estado sólido al gaseoso o al de vapor sin pasar por el estado líquido, necesitandose calor.
Solidificación: Este cambio requiere eliminar calor y ocurre cuando un líquido pasa al estado sólido.
Condensación: Es el paso del estado de vapor al estado líquido. Este cambio también supone la eliminación del calor.
Licuefacción: Es el paso del estado gaseoso al estado líquido. Además de eliminar calor debe aumentarse la presión para conseguir el cambio

Subtopic
Video presentación
1.8. Periodicidad química.
Periodicidad química es una tendencia o patrón que exhiben los elementos químicos para un conjunto de sus propiedades químicas y físicas. Viene a ser una especie de parentesco, la cual fue guía fundamental para que los padres de la química organizaran y clasificaran todos los elementos en la hoy conocida tabla periódica.
Los 118 elementos existentes (entre naturales y artificiales) guardan, en distinta medida, una relación entre sí que les define en familias o grupos.
1.6. Clasificación de las sustancias naturales
por semejanzas en: propiedades físicas,
propiedades químicas.
Sustancias Naturales, que se encuentran directamente en la Naturaleza, como son las especies químicas que se extraen de las aguas potables y minerales, del agua de mar, de los fragmentos de rocas, de los minerales y vegetales, de la atmosfera, etc. Ejemplos: el agua, la sal de cocina, el salitre, el azufre, la morfina, el almidón, el azúcar, los aceites y grasas, los metales, el oxigeno.
Propiedades quimicas: Son aquellas que se refieren a la naturaleza intima de la sustancia o a la manera de reaccionar con otra. Ejemplo: La combustión del azufre para producir anhídrido sulfuroso, la explosión producida al quemar hidrogeno, la combustión de un trozo de cinta de magnesio para producir óxido de magnesio.
Propiedades fisicas: Son aquellas que pueden ser observadas sin cambiar la naturaleza de las sustancias ejemplo: color, olor, dureza, elasticidad, punto de fusion y punto de ebullicion.
1.9. Desarrollo de la tabla periódica moderna.

Henry Moseley, en 1912, demuestra que la tabla periódica debe ordenarse por el número atómico. La ley de Mendeleiév condujo a la tabla periódica actual, se utilizó el número atómico como número ordenador de los elementos, y se estructuró en dieciocho grupos o columnas y siete periodos o filas.
La tabla periódica de los elementos es una disposición de los elementos químicos en forma de tabla, ordenados por su número atómico, por su configuración de electrones y sus propiedades químicas. Este ordenamiento muestra tendencias periódicas como elementos con comportamiento similar en la misma columna.
1.7 Base experimental de la teoria cuántica y estructura atómica
Siglo V Leucipo (Mileto, hacia el 460 – 370 a.C.)
El siglo V a.c Leucipo sosteía que habia un sólo tipo de materia y pensaba que si dividíamos la materia en partes cada vez más pequeñas, obtendríamos un trozo que no se podría cortar más.
Filósofo griego al quien se atribuye la fundación del atomismo. La filosofía atomista de Leucipo y Demócrito podía resumirse en:
2.- Los átomos se diferencian en su forma y tamaño
3.- Las propiedades de la materia varían según el agrupamiento de los átomos.opic
1.- Átomos son eternos, indivisibles, homogéneos e invisibles.
Empédocles de Agrigento 495 o 484/3 a. C.
Postuló que la materia la componían particulas pequeñisima e intranformables (átomos) pero decía que no todas eran distintas, como suponía contemporáneo anaxágoras, sino que todas estaban formadas por cuatro elementos: fuego, agua, tierra y aire.
Anticipó, pues, el concepto de afinidad que tanta importancia adquiriría posteriormente en Química. Sin embargo él no consideraba la afinidad en el sentido energético y suponía que todos los cambios eran mecánicos.
Empédocles fue un precursor de la ciencia experimental antigua y afirmaba que se llega al conocimiento de un objeto siempre por lo semejante.
Así, por ejemplo, probó físicamente que el aire es un cuerpo material utilizando una clepsidra.
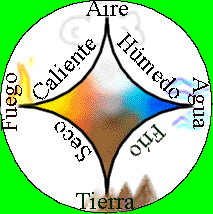
Aristóteles (384-322 a.c.)
Creía que la materia era contínua y podía dividirse interminablemente en porciones más pequeñas. Aristóteles pensaba que toda la naturaleza estaba compuesta de cuatro elementos: Tierra, Aire, Agua y Fuego.
1. El sistema formalizado del pensamiento. 2. La analogía política. 3. Los hallazgos en la medicina. 4. La importancia de la observación en la ciencia. 5. La forma de la Tierra.
Agregó el “éter” como quintaesencia. Nego la existencia de los átomos de Democrito

Reconocio la teoria de los 4 elementos
Demócrito (460 y 370 a.C.)
Primera vez con esta teoría el término "átomo". Así, la "teoría atómica" establece que la materia es tan sólo una mezcla de átomos (que en griego significa "indivisible"). Estos son elementos que inmutables, eternos e infinitamente pequeños y, por tanto, imperceptibles para los sentidos.
El desarrollo de la "teoría atómica del universo", que fue concebida originariamente por su mentor, el filósofo Leucipo. Demócrito acuñó por primera vez con esta teoría el término "átomo".

La idea del átomo
PLATÓN 427 a. C. y 347 a. C.
Es ampliamente reconocido como la primera persona en desarrollar el concepto de un átomo, la idea de que la materia está compuesta de algún componente indivisible a la escala más pequeña.
Introdujo la proposición de la teoría atómica de que las formas geométricas ideales sirven como átomos, según la cual los átomos se descomponen matemáticamente en triángulos, de tal manera que los elementos de la forma tienen la siguiente forma.

Tierra es mas estable para Platón por eso le asigno el cubo.
A los átomos en forma de tetraedro por considerarlo el elemento mas ligero y punzante.
Icosaedro fue asignado a los átomos de agua por Platón por considerarlo el elemento mas movil.
Platón asigno al aire los átomos en forma de octaedro de forma misteriosa.
Quinto elemento regular de platón es el dodecaedro y lo asigno el quinto indefinido elemento.
JOHN DALTON (Reino Unido), 17 de noviembre de 1766-Mánchester, 27 de julio de 1844) fue un naturalista, químico, matemático y meteorólogo británico.
La teoría atómica de Dalton se basa en cuatro supuestos;
Los elementos químicos están formados por partículas extremadamente pequeñas e indivisibles e indestructibles llamadas átomos.
Todos los átomos de un elemento particular son idénticos.
Los átomos de diferentes elementos pueden combinarse para formar otros compuestos.
Las reacciones químicas consisten únicamente en la separación, unión o reordenamiento de átomos.
La teoría atómica de Dalton también permite una mejor descripción de los problemas del cambio químico:
Ley de las proporciones múltiples: si dos elementos forman más de un compuesto, existe una relación simple entre las diferentes cantidades de los dos elementos combinados, que se puede expresar en números enteros por peso. Por ejemplo: en H2O, mientras se combinan 2g de hidrógeno y 16g de átomos de oxígeno , en OH se combinan 1g de hidrógeno y 16g de oxígeno. Si comparamos 2g de hidrógeno y 1g de hidrógeno combinados con la misma cantidad de oxígeno en ambos compuestos, se obtiene el número 2.
Ley de conservación de la masa: La suma de las masas de las sustancias que reaccionan en una reacción química es igual a la suma de las masas de las sustancias (productos) liberadas.
J.J THOMSOM (18 de diciembre de 1856,30 de agosto de 1940)
El modelo atómico de Thomson es una teoría sobre la estructura atómica propuesta en 1904 por Thomson, quien descubrió el electrón en 1897, pocos años antes del descubrimiento del protón y del neutrón. ... El átomo se consideraba como una esfera con carga positiva con electrones repartidos como pequeños gránulos. Thomson recibió el Premio Nobel de Física en 1906 por sus estudios acerca del paso de la electricidad a través del interior de los gases. Calculó la cantidad de electricidad transportada por cada átomo y determinó el número de moléculas por centímetro cúbico.
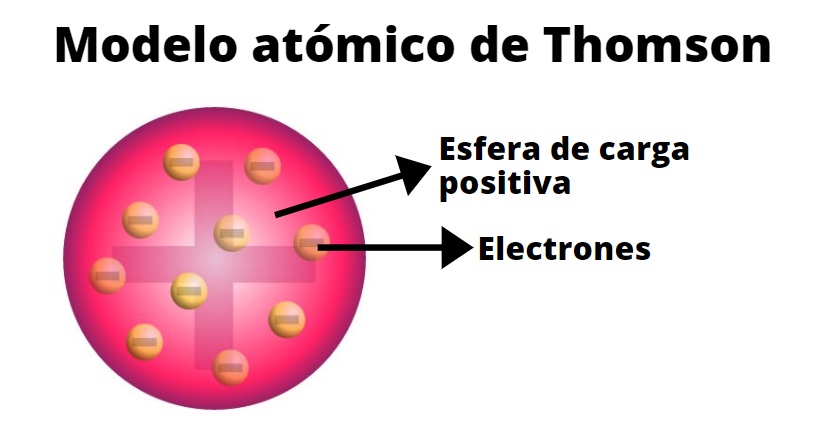
El modelo atómico de Thomson hizo que se descubriera la primer partícula subatómica, mejor conocida con el nombre de electrón. Ayudó a determinar la relación que existe con la carga de la masa del electrón. Logró además demostrar con la teoría que dentro del átomo se puede encontrar una partícula diminuta que tiene carga negativa, a los cuales llamó electrones. Dedujo también que el átomo era una esfera de materia que tenía carga positiva y que en su interior se encontraban los electrones.
Thomson demostró que dentro de los átomos hay unas partículas diminutas, con carga eléctrica negativa, a las que se llamó electrones.
Se le considera el descubridor del electrón por sus experimentos con el flujo de partículas (electrones) que componen los rayos catódicos.
La base de estos resultados propuso, en 1904, un modelo atómico conocido como modelo del pudín de ciruelas, según el cual los electrones eran como 'ciruelas' negativas incrustadas en un 'pudín' de materia positiva.
E. RUTHENFORD (30 de agosto de 1871 , 19 de octubre de 1937 66 años)
Modelo atómico, Rutherford propuso que los átomos tienen un núcleo central donde se encuentra el mayor porcentaje de su masa. ... La suma de las cargas eléctricas positivas y negativas de un átomo debería dar cero como resultado, es decir, deberían ser iguales, para que el átomo sea eléctricamente neutro.

Trabajos en el campo de la física atómica está considerado como uno de los padres de esta disciplina.
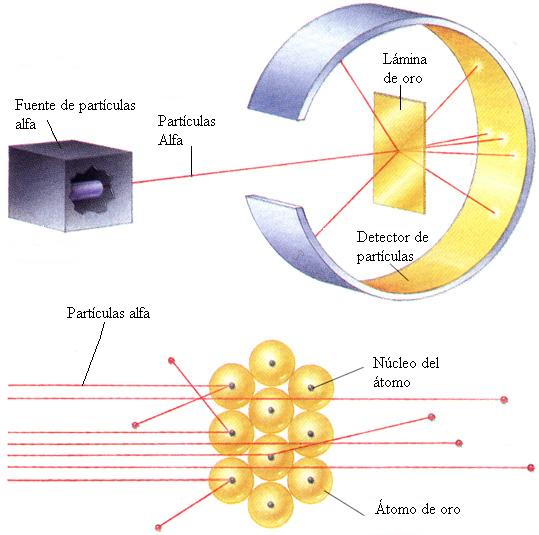
Su contribución más importante a la física fueron sus estudios sobre la dispersión de los rayos alfa producida al bombardear con ellos láminas delgadas de metales. Esta investigación le condujo, en 1911, a un nuevo modelo atómico, según el cual prácticamente toda la masa del átomo y toda su carga positiva están concentradas en un pequeñísimo espacio central, el núcleo atómico.
(1919) logró la primera transmutación artificial de elementos químicos mediante el bombardeo con partículas alfa de nitrógeno, que se transformó durante el proceso en un isótopo del oxígeno.
Antoine-Henri Becquerel fue un físico francés (París, 1852 - Le Croisic, 1908). Becquerel compartió el Premio Nobel de física del 1903 con el matrimonio Curie ( Pierre Curie y Marie Curie) por su investigación sobre la fluorescencia y el descubrimiento del fenómeno de la radiactividad.
Henri Becquerel efectuó varios experimentos que le llevaron a descubrir casualmente que un compuesto de uranio velaba las placas fotográficas envueltas en papel negro. En aquel año, Henri Becquerel estaba realizando experimentos con sales de uranio.
Una ocasión, empaquetó un fragmento de roca que contenía uranio en un papel negro en un armario con algunas placas fotográficas. Después de un tiempo desarrollando los azulejos, notó que las piedras habían sido impresas con mucha precisión.
Forma, Becquerel dedujo que este fenómeno era característico del átomo del uranio, descubriendo así la radiactividad natural.
De varios experimentos, concluyó que la radiactividad natural era propiedad de algunas sustancias, como el uranio, el radio y el polonio para emitir radiación sin ninguna causa externa.
Subtopic
1.10. Clasificación periódica de los elementos.
Elementos: son substancias simples que no pueden descomponerse por métodos químicos ordinarios en algo más sencillo. Actualmente se conocen 109 elementos diferentes, 92 de los cuales son naturales y el resto son artificiales.
Elementos se representan por símbolos y están ordenados por un número y por sus propiedades en un arreglo llamado tabla periódica.
Cada elemento químico contiene un enlace que explica sus propiedades químicas, efectos sobre la salud, efectos sobre el medio ambiente, datos de aplicación, fotografía y también información acerca de la historia y el descubridor de cada elemento. También puede consultar el apartado especial de terminología de los efectos de las radiaciones sobre la salud.
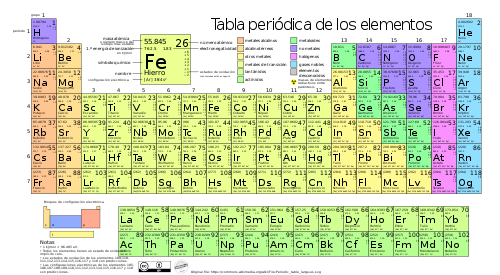
Tabla periódica
1.11. Propiedades atómicas y variaciones
periódicas: carga nuclear efectiva, radio
atómico, radio iónico, energía de
ionización, afinidad electrónica,
electronegatividad.
Carga nuclear efectiva
La carga nuclear efectiva es la carga positiva neta experimentada por un electrón en un átomo polielectrónico. El término "efectiva" se usa porque el efecto pantalla de los electrones más cercanos al núcleo evita que los electrones en orbitales superiores experimenten la carga nuclear completa. Es posible determinar la fuerza de la carga nuclear observando el número de oxidación del átomo.En un átomo con un electrón, el electrón experimenta toda la carga del núcleo positivo. En este caso, la carga nuclear efectiva puede ser calculada usando la ley de Coulomb.Sin embargo, en un átomo con muchos electrones, los electrones externos son, simultáneamente, atraídos al núcleo debido a su carga positiva, y repelidos por los electrones cargados negativamente.
Radio Atómico:
Muchas propiedades físicas como la densidad, puntos de ebullición y de fusión tienen relación con el tamaño del átomo, la densidad electrónica se extiende mas allá del núcleo por lo cual se piensa en el tamaño atómico como el volumen que contiene cerca de 90% de la densidad electrónica alrededor del núcleo.

Radio Iónico:
Es el radio de los cationes y aniones. Se mide por difracción de rayos X.
El radio iónico afecta propiedades químicas y físicas de los
compuestos iónicos.

Potencial de ionización:
Existe una relación entre la configuración electrónica y el comportamiento químico. La estabilidad de los electrones es reflejada en la energía de ionización de los átomos.
La energía de ionización es la energía mínima es expresada en kj/mol, Esta es la cantidad de energía necesaria para separar un mol de electrones de un mol de átomos en estado gaseoso.
Afinidad Electrónica:
Es la capacidad de un átomo de aceptar uno o más electrones, Es un cambio de energía que sucede cuando un átomo en estado gaseoso acepta un electrón en forma de anión.

Electronegatividad:
Es la capacidad que tiene un átomo para atraer electrones. De la misma manera que la afinidad electrónica y la energía de ionización, la electronegatividad aumenta hacia arriba y ala derecha en la tabla periódica.
1.12. Propiedades químicas y su variación
periódica: tendencias generales y por
grupo.
Aquellas que se refieren a la naturaleza intima de la sustancia o a la manera de reaccionar con otra.
PROPIEDAD QUÍMICA:
La tabla periódica puede dividirse en diversas formas según las propiedades que se deseen estudiar, de tal manera que se agrupan conjuntos de elementos con características comunes.
METALES, NO METALES Y METALOIDES
Las propiedades químicas de los elementos dependen de la distribución electrónica en los diferentes niveles, por ello; todos aquellos que tienen igual número de electrones en su último nivel presentan propiedades químicas similares.
Propiedades químicas y su variación periódica:
tendencias generales y por grupo
Reactividad
Acidez
Combustión
Oxidación
Alcalinidad
Grado de disociación
Demanda de Oxigeno
Las características de los elementos metálicos son:
Características de los elementos metálicos son: 1. Conducen con facilidad el calor y la electricidad.
2. Presentan brillo metálico
3. Generalmente pueden ser laminados o estirados formando alambres, propiedades que se conocen como MALEABILIDAD y DUCTILIDAD.
4. Por lo regular a temperatura ambiente son sólidos excepto Hg, Ga, Cs y Fr.
5. Al combinarse con NO METALES ceden electrones por lo que adquieren cargas positivas (CATIONES).
NO METALES presentan las siguientes características:
1. Son malos conductores del calor y la electricidad.
2. No son maleables ni dúctiles.
3. Reciben electrones al combinarse con los METALES adquiriendo así cargas NEGATIVAS (ANIONES).
Los METALOIDES:
1.13. Elementos de importancia económica,
industrial y ambiental en la región o en el
país
Elementos son sumamente importantes
Elementos de importancia económia: Hidrogeno(H), Boro(B), Carbono(C), Nitrogeno(N), Oxigeno(O), Flour(F), Cloro(CI).
Elementos de importancia Industrial: Aluminio, Mercurio, Antimonio, Plata, Cobre, Plomo, Hierro, Oro.
Elementos de importancia ambiental: Bomo, Azufre, Cadmio, Mercurio, Antimonio, Arsenico, Fosforo, Plomo, Cloro, Cromo, Manganeso.