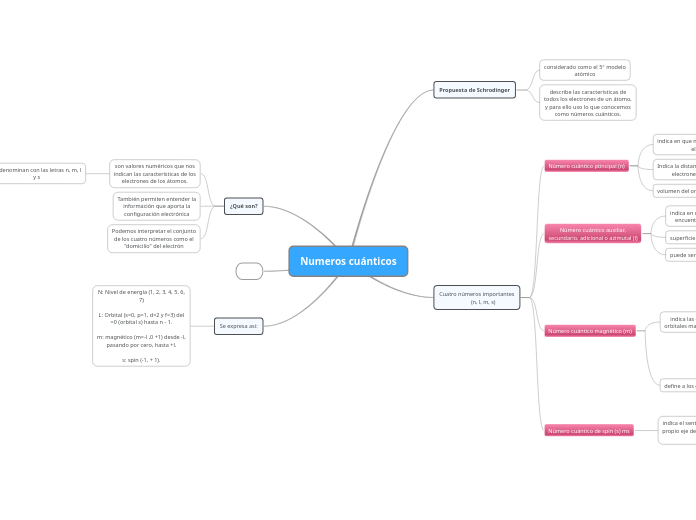
Numeros cuánticos
Propuesta de Schrodinger
considerado como el 5° modelo
atómico
describe las características de
todos los electrones de un átomo,
y para ello uso lo que conocemos
como números cuánticos.
Cuatro números importantes
(n, l, m, s)
Número cuántico ptincipal (n)
indica en que nivel se encuentra el
electrón
toma valores enteros positivos del
1 al 7
Indica la distancia media de los
electrones al núcleo
volumen del orbital
Número cuántico auxiliar,
secundario, adicional o azimutal (l)
indica en que subnivel se
encuentra el electrón
toma valores desde 0 hasta (n - 1)
superficie de los orbitales
puede ser s, p, d y f (0, 1, 2 y 3).
Número cuántico magnético (m)
indica las orientaciones de los
orbitales magnéticos en el espacio
el número magnético depende de
1
toma valores de -1 hasta 1
Asume valores del número
cuántico secundario negativo (-l)
pasando por cero, hasta el número
cuántico positivo (+l)
los orbitales magnéticos son las
regiones de la nube electrónica
donde se encuentran los
electrones
define a los orbitales
Número cuántico de spin (s) ms
indica el sentido de rotación en el
propio eje de los electrones en un
orbital
toma los valores de -1/2 y de 1/2.
determina el lugar donde se
encuentra un electrón
determinado y los niveles de
energía del mismo
importante en el estudio de las
radiaciones, la energía de
ionización, así como de la energía
liberada por un átomo en una
reacción.
¿Qué son?
son valores numéricos que nos
indican las características de los
electrones de los átomos.
se denominan con las letras n, m, l
y s
También permiten entender la
información que aporta la
configuración electrónica
Podemos interpretar el conjunto
de los cuatro números como el
"domicilio" del electrón
s
Se expresa así:
N: Nivel de energía (1, 2, 3, 4, 5, 6,
7)
L: Orbital (s=0, p=1, d=2 y f=3) del
=0 (orbital s) hasta n - 1.
m: magnético (m=-l ,0 +1) desde -l,
pasando por cero, hasta +l.
s: spin (-1, + 1).