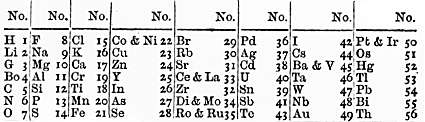
Proceso histórico de la construcción de la tabla periódica
1814

Jacobo Berzelius
Clasificó los elementos considerando dos aspectos: Electropositivos: los que pierden electrones (metales) Electronegativos: los que ganan electrones (no metales)

Propuso la notación que aún hoy se utiliza, al sustituir los círculos y puntos de los símbolos de Dalton por letras, tomando como base la inicial o las dos primeras letras del nombre del elemento escrito en latín.
1815

Propuso el ordenamiento en base al Hidrógeno. La hipótesis de Prout fue un intento realizado para explicar la existencia de varios elementos químicos a través de una hipótesis sobre la estructura interna del átomo.

William Prout
1817

Johann Wolfgang Döbereiner
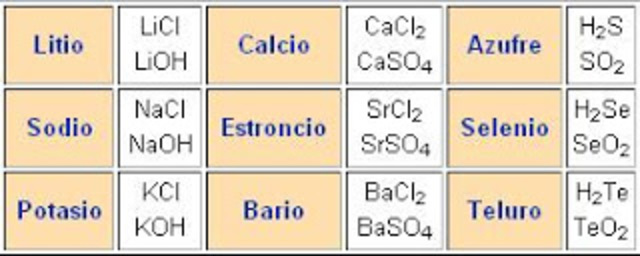
Él destaca la existencia de similitudes entre elementos agrupados en tríos que él denomina “tríadas”. La tríada del cloro, del bromo y del yodo es un ejemplo. Pone en evidencia que la masa de uno de los tres elementos de la triada es intermedia entre la de los otros dos.
1862
El desarrollo de la ley de las octavas; se dio cuenta de que existía un patrón en la composición atómica de la mayoría de los elementos químicos presentes en la Tierra.

John Alexander Reina Newlands
1869

Julius Lothar Meyer
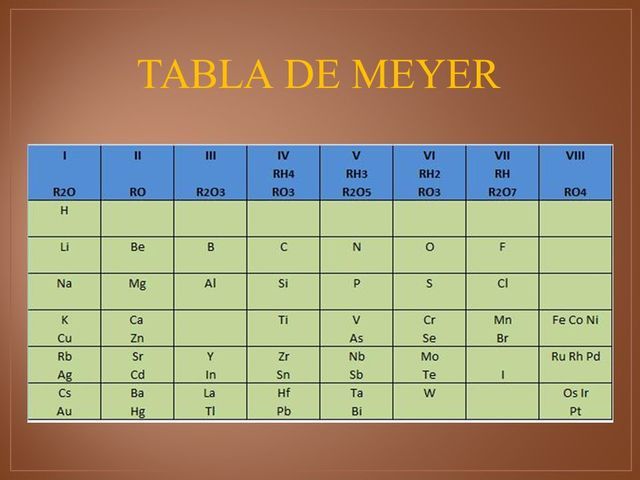
Pone en evidencia una cierta periodicidad en el volumen atómico. Los elementos similares tienen un volumen atómico similar en relación con los otros elementos. Los metales alcalinos tienen por ejemplo un volumen atómico importante.
1869

Presenta una primera versión de su tabla periódica en 1869. Esta tabla fue la primera presentación coherente de las semejanzas de los elementos. El se dio cuenta de que clasificando los elementos según sus masas atómicas se veía aparecer una periodicidad en lo que concierne a ciertas propiedades de los elementos. La primera tabla contenía 63 elementos.

Dmitri Ivánovich Mendeléyev
1912

Henry Moseley

Ordenó los elementos según su número atómico. En química avanzada proporcionó un apoyo fundamental al modelo atómico de Bohr mencionando que los núcleos atómicos contienen cargas positivas iguales a su número atómico.