por Magali Gomez 3 anos atrás
116
Modelos Átomicos
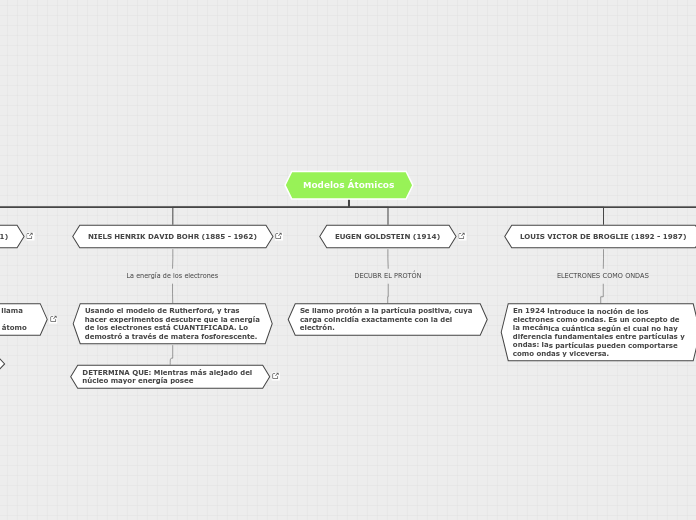
A lo largo de la historia, varios científicos han contribuido significativamente al desarrollo de la teoría atómica. Eugen Goldstein, en 1914, descubrió el protón, una partícula con carga positiva.
por Magali Gomez 3 anos atrás
116

Mais informações
PROTONES
NEUTRONES
ELECTRONES
Orbitales: Los electrones con diversos valores de momento angular ocupan regiones del espacio como éstas.
DETERMINA QUE: Mientras más alejado del núcleo mayor energía posee
PREDIJO EL NEUTRON.
Los electrones se incrustan en el átomo como las pasas al pudín
Sist. Establecido por Dalton para Distinguir los elementos