FORMULACION INORGANICA
COMPUESTOS TERNARIOS
OXOACIDOS
Consisten en O2 y un elemento central H en combinaciones ternarias. Un metal de alta valencia con una valencia de cinco o más también puede ser el elemento central, que normalmente es un no metal.
La fórmula se puede determinar mezclando agua con los óxidos del elemento central mientras se encuentran en el mismo estado de oxidación. Sin embargo, se pueden producir diferentes oxoácidos añadiendo varias cantidades de agua a diferentes óxidos. Estos son los "ácidos especiales", como su nombre lo indica.
(en desuso Valencias 1-(hipo/oso) 2/3-(-oso) ACIDO + 4/5-(-ico) 6/7-(per-ico)
Nomenclatura con hidrógeno Prefijo multiplicativo+hidrogeno(oxido+no metal+ato)
Ejemplo(H²SO⁴)
-Nombre tradicional>ácido sulfúrico
-Nomenclatura de hidrogeno>dihidrogeno(tatraoxidosulfato)
manufactura de abonos, explosivos, otros ácidos y pegamento; en la purificación de petróleo, en el tratamiento de metales; y en baterías de plomo-ácido
El ácido sulfúrico es un líquido aceitoso, incoloro y de olor particular, dependiendo de su concentración. Tiene un punto de fusión de 10 °C y un punto de ebullición de 337 °C. Su densidad es de 1,84g/cm3. Es miscible (soluble) con agua, pero genera calor, dado su enorme efecto deshidratante.
H2SO3 Trioxosulfato (IV) de hidrógeno/Ácido sulfuroso
síntesis de productos químicos y medicinales, elaboración del papel, reactivo analítico y para el refinado de productos derivados del petróleo
Es un líquido incoloro, inestable y de fuerte olor a azufre; se emplea en la síntesis de productos químicos y medicinales, elaboración del papel, reactivo analítico y para el refinado de productos derivados del petróleo.
OXOSALES
Las oxosales son compuestos iónicos cristalinos que resultan de sustituir los H+ de un oxoácido por otro catión (ya sea un catión metálico Mem+ o el ion amonio NH4+). Las oxosales, igual que las sales binarias, son sólidos iónicos
ICO>ATO OSO>ITO
Nomenclatura de posición
Nomenclatura tradicional
CaCO3 Trioxocarbonato (IV) de calcio/Carbonato cálcico
se usa como un antiácido para aliviar la pirosis (acidez o calor estomacal), indigestión ácida, y el malestar estomacal
El carbonato de calcio tiene muchas propiedades: alto brillo y opacidad, partículas compactas, inodoro, conductividad térmica, insolubilidad en el agua... Por eso se utiliza en muchos campos industriales para diversos y variados usos.
NaNO3 Trioxonitrato (V) de sodio/Nitrato sódico
aditivo alimentario para fijar el color, es un conservante y un agente preventivo de una enfermedad que causa parálisis muscular
Propiedades. Se trata de una sustancia incolora, inodora y altamente oxidante. Mezclado con sustancias orgánicas puede provocar explosiones.
OXOAXIONES
Si usa el E.O menor, la nomenclatura del oxoanión será de la forma: "hipo"+"elemento central"+"ito". Ejemplos: hipoclorito, hipobromito. Si usa el segundo E.O, la nomenclatura del oxoanión será de la forma: "elemento central"+"ito". Ejemplos: clorito, bromito.
N+3[NO2]- 1 NITRITO
conservación de alimentos, algunos medicamentos, y en la producción de municiones y explosivos.
N+5[NO3]- 1 NITRATO
Una de las propiedades más destacadas del Nitrito de Sodio Cristal es su capacidad como agente conservante y antioxidante.
HIDROXIDOS
Combinaciones del hidróxido con un metal, siendo este siempre positivo.
Los hidróxidos se nombran con la palabra hidróxido seguida de la preposición “de» y el nombre del metal. Como viene siendo habitual, cuando sea necesario: Se indica mediante un prefijo multiplicador (di–, tri–, tetra–, etc.) el número de iones hidróxido que aparecen en la molécula.
Ejemplo
( Fe(OH)² )
-Prefijos multiplicadores>dihidroxido de hierro -Número de oxidacion>hidróxido de hierro(II)
-Número de carga>hidróxido de hierro²+
catalizador para la investigación proteómica.También se utiliza como producto farmacéutico intermediario
Mg(OH)2
Tradicional: Hidróxido magnésico.
Sistemática: Dihidróxido de magnesio.
Stock: Hidróxido de magnesio.
se usa para tratar el estreñimiento ocasional de corto plazo en niños y adultos
El hidróxido de magnesio pertenece a una clase de medicamentos llamados laxantes salinos
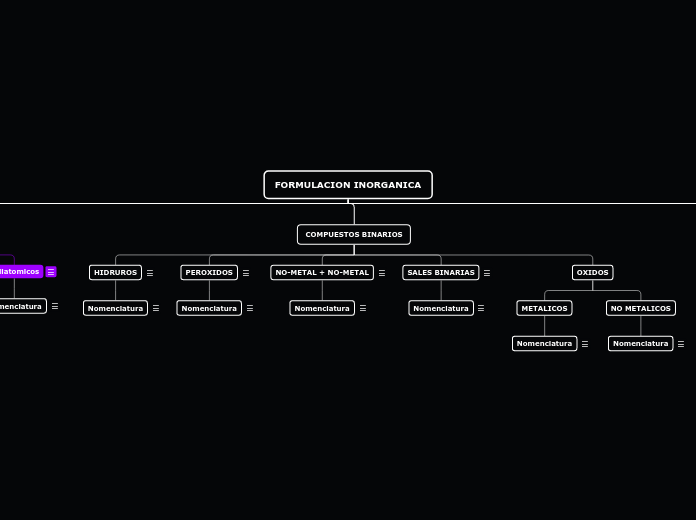
COMPUESTOS BINARIOS
OXIDOS
NO METALICOS
Prefijos multiplicadores
Número de oxidación
Número de carga
Anhídrido telúrico (TeO2)
aumentar la resistencia a la tensión, en la fabricación de rectificadores y dispositivos termoeléctricos y en la investigación de semiconductores
Se usa en algunas aleaciones de cobre y plomo para aumentar la resistencia a la tensión, en la fabricación de rectificadores y dispositivos termoeléctricos y en la investigación de semiconductores.
Anhídrido silícico (SiO2)
vulgarmente conocido por arena, arena de cuarzo, arena de silice, etc. Es en frío un cuerpo indiferente; pero a altas temperaturas actúa como un ácido al contacto con los metales ferruginosos formando silicatos de hierro.
METALICOS
Prefijos multiplicadores
Número de oxidación
Número de carga
trióxido de dialuminio (Al2O3) / Oxido de aluminio (III)
Limpieza de inox, hierro y decapado de soldaduras.
aislamiento eléctrico, una alta resistencia mecánica, una gran dureza, una gran resistencia a la corrosión y al desgaste y una conductividad térmica bastante alta para un material cerámico
óxido cúprico (CuO) / Monoxido de cobre
Para pigmentar cristales o colorante de cerámica
Se funde arriba de los 1200°C. Es insoluble en gran parte de disolventes. Reacciona con ácidos para formar sales de cobre. Es anfótero, por lo que puede disolverse en ácidos y soluciones alcalinas.
SALES BINARIAS
Son combinaciones de metal y no-metal.
La formulacion sigue el modelo:
MaNb
Donde:
M: elemento metálico.
N: elemento no metálico.
a: valencia del elemento no metálico.
b: valencia del elemento metálico.
Los sólidos iónicos como el sulfuro de potasio (K2S) son ejemplos de sales binarias. o sal de mesa, cloruro de sodio NaCl:.
El no metal, terminación -uro
Prefijos multiplicadores
Número de oxidación
Número de cargaEl no metal, terminación -uro
Prefijos multiplicadores
Número de oxidación
Número de carga
Ejemplo(FeF²)
-Prefijos multiplicativos>difluoruro de hierro -Número de oxidacion>fluoruro de hierro(II) -Número de carga>fluoruro de hierro²+
Cultivo celular y transfección
FeCl2: Cloruro ferroso
teñido de textiles, metalurgía, industria farmacológica, y tratamientos de aguas residuales
NO-METAL + NO-METAL
Son sustancias formadas por la unión de dos elementos no metálicos; en este grupo de compuestos encontramos los óxidos no metálicos y los halogenuros sulfuros de no metales. En general, presentan enlaces covalentes y forman moléculas.
son compuestos binarios formados por la unión de dos elementos de la siguiente lista: B, Si, C, Sb, As, P, N, Te, Se, S, O, I, Br, Cl, F
PEROXIDOS
combinaciones de un elemento de los grupos 1 o 2 y el ion peróxido O22-. Siempre están presentes una o dos valencias, pero también podría tratarse de otro metal.
La nomenclatura sistemática de los peróxidos es la misma que la de los óxidos (K2O2), dióxido de dipotasio; CaO2, dióxido de calcio)
BaO2 Dióxido de bario/Peróxido bárico
Se utiliza para secar gases y solventes, y como detergente en aceites lubricantes.
ZnO2 Dióxido de Zinc/Peróxido cíncico
El Óxido de Zinc es utilizado en la industria de plásticos para evitar la decoloración, mantener la estabilidad del calor y mantener la transparencia del producto
HIDRUROS
Estas son combinaciones H que son binarias con otro elemento. Clasificamos los hidruros en metálicos o no metálicos según su naturaleza.
Crean enlaces Ionicos
Su formula es:
A + H2 = AH2
(A= Elemento)
Ejemplo(F²H²)
-Prefijo multiplicadores>Dihidruro de hierro
-Numeró de oxidacion>hidruro de hierr-Numeró de carga>hidruro de hierro ²+o (II) Ejemplo(F²H²)
-Prefijo multiplicadores>Dihidruro de hierro
-Numeró de oxidacion>hidruro de hierro (II)
-Numeró de carga>hidruro de hierro ²+
FeH3 trihidruro de hierro/hidruro férrico
explosivos y pirotecnia, como combustible de cohetes y en la fabricación de otras sustancias químicas.
AgH hidruro de plata/hidruro argéntico
Fabricación de baterías de autos por su alto potencial electrico
Hidruro de Plata es un compuesto metálico, usado comúnmente para la fabricación de baterías para coches, debido a su alto potencial eléctrico.
IONES
Poliatomicos
El prefijo poli- significa muchos, por lo que un ion poliatómico es aquel que contiene más de un átomo. Esto distingue los iones poliatómicos de los iones monoatómicos, que solo contienen un átomo. Podemos pensar en los iones poliatómicos al compararlos con los iones monoatómicos. Un ion monoatómico es un átomo que se convirtió en un ion al ganar o perder electrones. El ion tiene una carga neta porque el número total de electrones no está balanceado con el número total de protones en el núcleo. Así, al comparar con el átomo neutro, tenemos electrones adicionales, en caso del anión con carga negativa, o bien electrones insuficientes, en caso de un catión con carga positiva. Por ejemplo, un átomo neutro de cloro tiene un número atómico de 17, es decir, tiene 17 protones y 17 electrones.
el nombre de cationes poliatómicos termina con —ium, y el nombre de aniones poliatómicos termina con —ide, excepto los oxianiones que tienen reglas separadas para su nomenclatura.
NaNO 3 = nitrato de sodio
aditivo alimentario para fijar el color, es un conservante y un agente preventivo de una enfermedad que causa parálisis muscular
temperatura ambiente se encuentra como líquido cristalino, de color blanco, sin olor y altamente oxidante. Su punto de fusión es de 308°C
FeCo 3 = carbonato de hierro (II)
complemento en pre-mezclas minerales para alimentación animal como aporte de hierro.
Se presenta en un color de pardo amarillento a gris, también presenta un lustre vítreo, sedoso y nacarado.
Monoatomicos
Debido a que hay tantos protones con carga uno como electrones con carga uno, los átomos son eléctricamente neutros. Como resultado, la carga neta del átomo es cero porque las cargas positivas totales de los protones cancelan las cargas negativas totales de los electrones. Sin embargo, la mayoría de los átomos pueden ganar o perder electrones y, cuando esto ocurre, el número de electrones en el núcleo del átomo difiere del número de protones. Un ion es el nombre que se le da a la especie química cargada resultante. tanto cationes como aniones. El número total de electrones en un átomo neutro disminuye cuando uno o más de ellos se pierden, pero el número de protones en el núcleo permanece constante. El resultado es que el átomo se transforma en un catión, un ion con carga neta positiva. Alternativamente, podría tener lugar un proceso. El número de electrones aumenta cuando un átomo neutro gana uno o más electrones, mientras que el número de protones en el núcleo permanece constante. Como resultado, el átomo se transforma en un anión, un ion con carga neta negativa. Examinar algunos cationes y aniones extremadamente básicos (aquellos que se crean cuando un solo átomo de hidrógeno pierde o gana un electrón) puede ayudar a ilustrar esto.
Nomenclatura
El nombre de un anión monoatómico consiste en el tallo del nombre del elemento, el sufijo - ide, y luego la palabra ion.
Ejemplos:
Magnesio Mg2+
regula la función de los músculos y el sistema nervioso, los niveles de azúcar en la sangre, y la presión sanguínea. Además, ayuda a formar proteína, masa ósea y ADN
metal liviano, medianamente fuerte y de color blanco plateado
Calcio Ca2+
Muy importante en el cuerpo humano
es trimorfo, más duro que el sodio, pero más blando que el aluminio
SUSTANCIAS PURAS
sistema homogéneo a partir del cual no es posible obtener otras sustancias por medio de métodos de fraccionamiento.
Se nombran mediante su letra dependiendo del elemento
H = Hidrogenos
Na = Sodio
K = Potasio