La tabla periódica
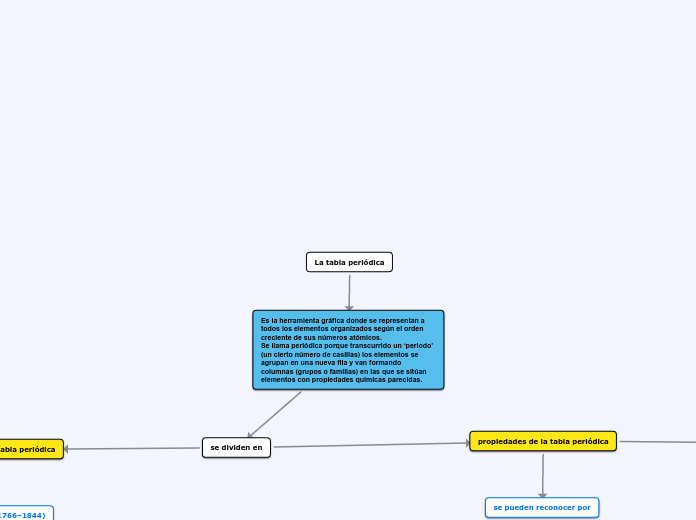
Es la herramienta gráfica donde se representan a todos los elementos organizados según el orden creciente de sus números atómicos.
Se llama periódica porque transcurrido un ‘periodo’ (un cierto número de casillas) los elementos se agrupan en una nueva fila y van formando columnas (grupos o familias) en las que se sitúan elementos con propiedades químicas parecidas.
se dividen en
propiedades de la tabla periódica
ventajas y desventajas de la tabla periódica de Mendeleïev
desventajas
1. Una desventaja o incompatibilidad en la tabla periódica de Mendeleiev fue que hubieron algunos elementos que no cumplieron el orden creciente de sus pesos atómicos.
2. Una desventaja de la tabla de Mendeleiev fue que no consideró a los gases nobles (en ese momento aún no se habian descubierto)
3. Mendeleiev solo consideró que un elemento químico solo tenia 1 valencia. Actualmente se conocen que los elementos químicos tienen mas de 1 valencia
ventajas
1. Mendeleiev ordenó a los elementos químicos en orden creciente a su peso atómico. Actualmente se ordena a los elementos en orden creciente a su número atómico.
2. Una ventaja de la tabla de Mendeleiev fue que todos los elementos químicos pertenecientes a un mismo grupo o familia tenían las mismas propiedades químicas y el mismo número de valencia.
3. Una ventaja de la tabla de Mendeleiev fue que dejo casilleros en blanco, prediciendo la existencia de nuevos elementos químicos.
se pueden reconocer por
Electronegatividad
Afinidad electrónica.
Radio atómico
Es la distancia promedio entre el núcleo atómico y la capa electrónica, más externa, también es una propiedad periódica y su variación se muestra, de forma regular, en que los átomos con mayor radio son los metales alcalinos y los de menores dimensiones son los halógenos.
Es la cantidad de energía liberada cuando un átomo gaseoso y en su estado fundamental capta un electrón libre y se convierte en un ion negativo con carga eléctrica
Es la fuerza de atracción que un átomo ejerce sobre los electrones que intervienen en el enlace químico.
Evolución de la tabla periódica
John Dalton (1766–1844)
Döbereiner
Chancourtois y Newlands
Meyer
Mendeleïev
Mendeleïev, químico ruso, presenta una primera versión de su tabla periódica en 1869. Esta tabla fue la primera presentación coherente de las semejanzas de los elementos. El se dio cuenta de que clasificando los elementos según sus masas atómicas se veía aparecer una periodicidad en lo que concierne a ciertas propiedades de los elementos. La primera tabla contenía 63 elementos.
pone en evidencia una cierta periodicidad en el volumen atómico. Los elementos similares tienen un volumen atómico similar en relación con los otros elementos. Los metales alcalinos tienen por ejemplo un volumen atómico importante.
En 1864 Chancourtois y Newlands, químico inglés, anuncian la Ley de las octavas: las propiedades se repiten cada ocho elementos. Pero esta ley no puede aplicarse a los elementos más allá del Calcio. Esta clasificación es por lo tanto insuficiente, pero la tabla periódica comienza a ser diseñada.
Este químico alcanzó a elaborar un informe que mostraba una relación entre la masa atómica de ciertos elementos y sus propiedades en 1817. Él destaca la existencia de similitudes entre elementos agrupados en tríos que él denomina “tríadas”. La tríada del cloro, del bromo y del yodo es un ejemplo. Pone en evidencia que la masa de uno de los tres elementos de la triada es intermedia entre la de los otros dos. En 1850 pudimos contar con unas 20 tríadas para llegar a una primera clasificación coherente.
A principios del siglo XIX, John Dalton (1766–1844) desarrolló una nueva concepción del atomismo, al que llegó gracias a sus estudios meteorológicos y de los gases de la atmósfera. Estableció como unidad de referencia la masa de un átomo de hidrógeno (aunque se sugirieron otros en esos años) y refirió el resto de los valores a esta unidad, por lo que pudo construir un sistema de masas atómicas relativas.