realizată de Marco Isbén Castañeda García 2 ani în urmă
163
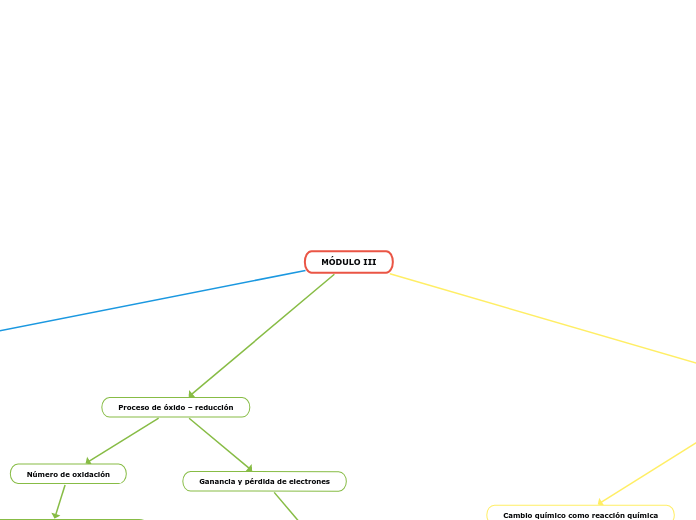
MÓDULO III
Las reacciones químicas pueden clasificarse según la energía que liberan o requieren, y se dividen en exotérmicas y endotérmicas. Además, se organizan por el tipo de proceso en el que los reactivos se transforman, como las reacciones de síntesis, donde dos o más sustancias se combinan para formar un producto más complejo, y las de descomposición, donde un compuesto se divide en sustancias más simples.