Principales grupos funcionales orgánicos
Ácidos carboxílicos
Los ácidos carboxílicos de mayor aplicación industrial son el ácido acético que se utiliza fundamentalmente para la obtención de acetato de vinilo que se utiliza como monómero para la fabricación de polímeros.
También se utiliza en la producción de acetato de celulosa para la obtención de lacas y películas fotográficas, así como en la fabricación de disolventes de resinas y lacas.
La sal alumínica del ácido acético se emplea como mordiente en tintorería. El ácido fórmico se suele emplear en la industria del curtido al objeto de suavizar las pieles y también en los procesos de tintorería en la industria del curtido. Algunos derivados clorados de los ácidos carboxílicos se emplean en la producción de herbicidas.
El comportamiento químico de los ácidos carboxílicos está determinado por el grupo carboxilo -COOH. Esta función consta de un grupo carbonilo (C=O) y de un hidroxilo (-OH). Donde el -OH es el que sufre casi todas las reacciones: pérdida de protón (H+) o reemplazo del grupo –OH por otro grupo.
-Son dependientes, cuyos cambios podrian originar los derivados de ácido. En este caso la reacción de esta función se sustituye el H del oxhidrilo o todo el -OH.
-Son resistentes a la oxidación y a la reducción pero el hidruro de litio y aluminio los reduce hasta los alcoholes.
-Según Bronsted, este grupo es ácido porque puede ceder un ion de hidrógeno.
-Los ácidos carboxílicos reaccionan rapidamente con soluciones acuosas de hidróxido de sodio y bicarbonato de sodio formando sales de sodio solubles.
El grupo carboxilo define la cadena más larga de la molécula y a su carbono le corresponde el número 1, numerándose los sustituyentes unidos a la cadena de la manera habitual. Los ácidos aromáticos se nombran como productos de sustitución del ácido benzoico, PhCOOH (p. f. 122°), o del hidrocarburo aromático de que deriven.
Los ácidos carboxílicos hierven a temperaturas muy superiores que los alcoholes, cetonas o aldehidos de pesos moleculares semejantes. Los puntos de ebullición de los ácidos carboxílicos son el resultado de la formación de un dímero estable con puentes de Hidrógeno.
Las sales del SODIO y el POTASIO de la mayoría de estos ácidos son facilmente solubles en agua.Estas sales son los principales ingredientes del jabón.
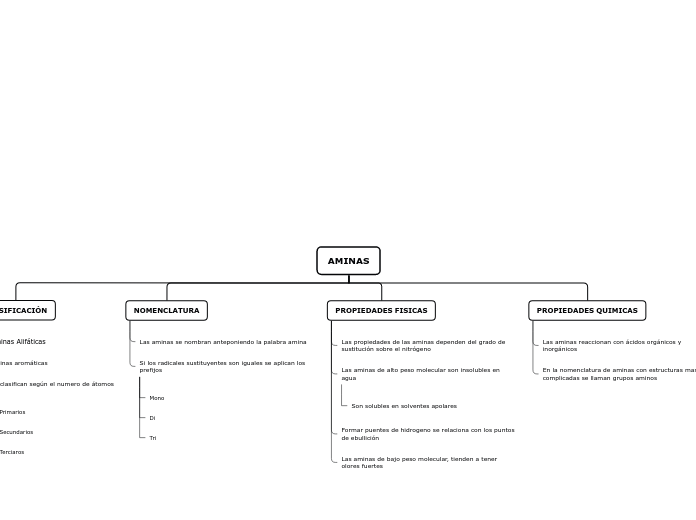
Aminas
Se encuentran formando parte de la naturaleza, en los aminoácidos que conforman las proteínas que son un componente esencial del organismo de los seres vivos. Al degradarse las proteínas se descomponen en distintas aminas. Unas emiten olor desagradable.
Las aminas como compuestos son muy importantes y reconocidas en industrias como las cosméticas y textiles por el uso o aplicación de la p-Fenilendiamina y algunos derivados se usan en composiciones para teñir el pelo y como antioxidantes para caucho.
Las aminas presentan puntos de fusión y ebullición más bajos que los alcoholes. Así, la etilamina hierve a 17ºC, mientras que el punto de ebullición del etanol es de 78ºC.
CH3CH2OH P.eb. = 78ºC
CH3CH2NH2 P. eb. = 17ºC
La menor electronegatividad del nitrógeno, comparada con la del oxígeno, hace que los puentes de hidrógeno que forman las aminas sean más débiles que los formados por los alcoholes.
Las aminas presentan reacciones de neutralización con los ácidos y forman sales de alquilamonio (también denominadas sales de amina). Por ejemplo la etilamina se combina con el ácido clorhídrico, para producir cloruro de etilamonio.
El cloruro de etilamonio es una sal de alquilamonio. Un grupo etilo y tres átomos de hidrógeno están unidos al átomo de nitrógeno en este compuesto. Si la dietilamina, (CH3CH2)2NH, se combina con el HBr se produce el brumuro de dietilamonio, una sal de dialquilamonio.
Las aminas son compuestos incoloros que se oxidan con facilidad lo que permite que se encuentren como compuestos coloreados. Los primeros miembros de esta serie son gases con olor similar al amoníaco. A medida que aumenta el número de átomos de carbono en la molécula, el olor se hace similar al del pescado.
Solubilidad: Las aminas primarias y secundarias son compuestos polares, capaces de formar puentes de hidrógeno entre sí y con el agua, esto las hace solubles en ella. La solubilidad disminuye en las moléculas con más de 6 átomos de carbono y en las que poseen el anillo aromático.
Punto de Ebullición: El punto de ebullición de las aminas es más alto que el de los compuestos apolares que presentan el mismo peso molecular de las aminas. El nitrógeno es menos electronegativo que el oxígeno, esto hace que los puentes de hidrógeno entre las aminas se den en menor grado que en los alcoholes.
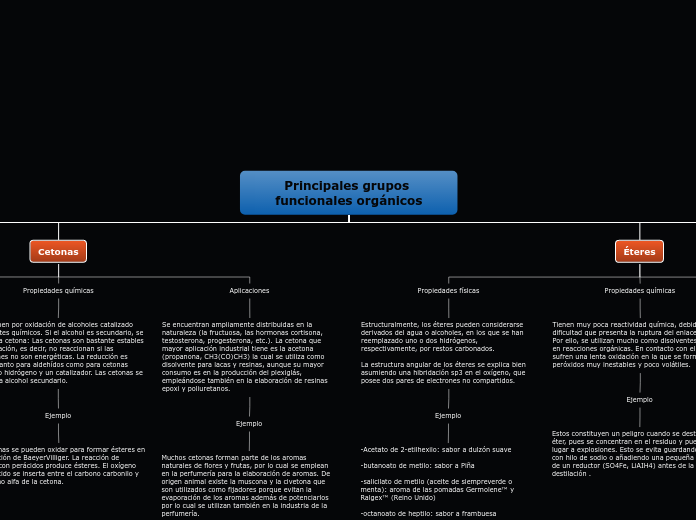
Éteres
Son múltiples las aplicaciones que tienen estos compuestos. La más utilizada es como disolventes de aceites y grasas. Otras de sus aplicaciones son: Anestésico general. Medio extractar para concentrar ácido acético y otros ácidos. Medio de arrastre para la deshidratación de alcoholes etílicos e isopropílicos.
Disolvente de sustancias orgánicas (aceites, grasas, resinas, nitrocelulosa, perfumes y alcaloides). Combustible inicial de motores Diesel.
Tienen muy poca reactividad química, debido a la dificultad que presenta la ruptura del enlace C—O. Por ello, se utilizan mucho como disolventes inertes en reacciones orgánicas. En contacto con el aire sufren una lenta oxidación en la que se forman peróxidos muy inestables y poco volátiles.
Estos constituyen un peligro cuando se destila un éter, pues se concentran en el residuo y pueden dar lugar a explosiones. Esto se evita guardando el éter con hilo de sodio o añadiendo una pequeña cantidad de un reductor (SO4Fe, LiAIH4) antes de la destilación .
Estructuralmente, los éteres pueden considerarse derivados del agua o alcoholes, en los que se han reemplazado uno o dos hidrógenos, respectivamente, por restos carbonados.
La estructura angular de los éteres se explica bien asumiendo una hibridación sp3 en el oxígeno, que posee dos pares de electrones no compartidos.
-Acetato de 2-etilhexilo: sabor a dulzón suave
-butanoato de metilo: sabor a Piña
-salicilato de metilo (aceite de siempreverde o menta): aroma de las pomadas Germolene™ y Ralgex™ (Reino Unido)
-octanoato de heptilo: sabor a frambuesa
-etanoato de isopentilo: sabor a plátano
-pentanoato de pentilo: sabor a manzana
-butanoato de pentilo: sabor a pera o a albaricoque
-etanoato de octilo: sabor a naranja.
Cetonas
Se encuentran ampliamente distribuidas en la naturaleza (la fructuosa, las hormonas cortisona, testosterona, progesterona, etc.). La cetona que mayor aplicación industrial tiene es la acetona (propanona, CH3(CO)CH3) la cual se utiliza como disolvente para lacas y resinas, aunque su mayor consumo es en la producción del plexiglás, empleándose también en la elaboración de resinas epoxi y poliuretanos.
Muchos cetonas forman parte de los aromas naturales de flores y frutas, por lo cual se emplean en la perfumería para la elaboración de aromas. De origen animal existe la muscona y la civetona que son utilizados como fijadores porque evitan la evaporación de los aromas además de potenciarlos por lo cual se utilizan también en la industria de la perfumería.
Se obtienen por oxidación de alcoholes catalizado por agentes químicos. Si el alcohol es secundario, se obtiene la cetona: Las cetonas son bastante estables a la oxidación, es decir, no reaccionan si las condiciones no son energéticas. La reducción es sencilla tanto para aldehídos como para cetonas utilizando hidrógeno y un catalizador. Las cetonas se reducen a alcohol secundario.
Las cetonas se pueden oxidar para formar ésteres en la Oxidación de BaeyerVilliger. La reacción de cetonas con perácidos produce ésteres. El oxígeno del perácido se inserta entre el carbono carbonilo y el carbono alfa de la cetona.
Su punto de ebullición es mayor que el de los alcanos de igual peso molecular, pero menor que el de los alcoholes y ácidos carboxílicos en iguales condiciones. Esto se debe a la formación de dipolos y a la ausencia de formación de puentes de hidrógeno intermoleculares. Las cetonas son líquidas cuando tienen hasta 10 carbonos, las más grandes son sólidas.
Las pequeñas tienen un olor agradable, las medianas un olor fuerte y desagradable, y las más grandes son inodoras. Los compuestos de hasta cuatro átomos de carbono, forman puente de hidrógeno con el agua, lo cual los hace completamente solubles en agua. Igualmente son solubles en solventes orgánicos.
Aldehídos
Existen en la naturaleza aldehídos capaces de conferir sabores agradables, tal es el caso del cinnamaldehído, responsable del sabor característico de la canela. Por eso se suelen utilizar como saborizantes artificiales en muchos productos como golosinas o alimentos.
Se utiliza en la elaboración de uno de los llamados plásticos técnicos que se utilizan fundamentalmente en la sustitución de piezas metálicas en automóviles y maquinaria, así como para cubiertas resistentes a los choques en la manufactura de aparatos eléctricos.
Puntos de fusión
Formaldehído -92; Acetaldehído -121; Propionaldehído -81; n- Butiraldehído -99; n-Valeraldehído -91; Caproaldehído – ; Heptaldehído – 42; Fenilacetaldehído -; Benzaldehído -26.
Puntos de ebullición
Formaldehído -21; Acetaldehído 20; Propionaldehido 49; n-Butiraldehido 76; n-Valeraldehido 103; Caproaldehido 131; Heptaldehido 155; Fenilacetaldehído 194; Benzaldehído 178.
Solubilidad en agua expresada en g/100 g de H2O
Formaldehído, muy soluble; Acetaldehido, infinita; Propionaldehído, 16; n-Butiraldehído, 7; n-Valeraldehído, ligeramente soluble; caproaldehído, ligeramente soluble; Fenilacetaldehído ligeramente soluble; Benzaldehído, 0,3.
Adición de Oxígeno: El oxígeno oxida al aldehído hasta transformarlo en ácido.
Reducción del Nitrato de plata (AgNO3) amoniacal (Reactivo de Tollens).
La plata en medio amoniacal es reducida por el aldehído. Esto se verifica por la aparición de un precipitado de plata llamado espejo de plata en el fondo del tubo d ensayo.
Son compuestos orgánicos caracterizados por poseer el grupo funcional -CHO (carbonilo).1 Un grupo carbonilo es el que se obtiene separando un átomo de hidrógeno del formaldehído. Como tal no tiene existencia libre, aunque puede considerarse que todos los aldehídos poseen un grupo terminal carbonilo.
El metanal es un gas de olor penetrante que al ser aspirado produce irritación y lagrimeo. El etanal tiene un agradable olor a frutas. A partir del etanal y hasta el de doce átomos de carbono son líquidos. Los restantes son sólidos.
Alcoholes
Aplicaciones
Como materia prima, se utilizan en la obtención de otros compuestos orgánicos, en laboratorios. También como componente de productos industriales de uso cotidiano, como desinfectantes, limpiadores, solventes, base de perfumes.
Se utilizan en la fabricación de combustibles, especialmente en la industria de los biocombustibles, alternativa a los de origen fósil. Es frecuente verlos en hospitales, botiquines de primeros auxilios o similares.
Propiedades químicas
Presentan un carácter dipolar, semejante al del agua, debido a su grupo hidroxilo. Esto hace de ellos sustancias polares (con un polo positivo y uno negativo).
Si se hace reaccionar un alcohol con una base fuerte, el grupo hidroxilo se desprotona y el oxígeno retiene su carga negativa, actuando como un ácido.
Propiedades físicas
Son líquidos incoloros que presentan un olor característico, aunque también, con menos abundancia, pueden existir en estado sólido. Son solubles en agua ya que el grupo hidroxilo (-OH) tiene cierta similitud con la molécula de agua (H2O), lo que les permite formar puentes de hidrógeno.
Ejemplo
Los alcoholes suelen ser líquidos incoloros de olor característico, solubles en el agua en proporción variable y menos densos que ella. Al aumentar la masa molecular también aumentan sus puntos de fusión y ebullición, pudiendo ser sólidos a temperatura ambiente (por ejemplo el pentaerititrol funde a 260 °C).