realizată de ci gar 4 ani în urmă
1012
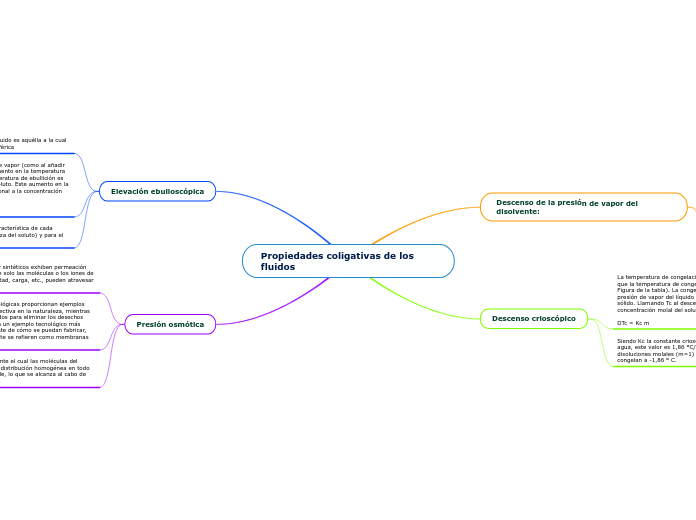
Propiedades coligativas de los fluidos
Las propiedades coligativas de los fluidos afectan diversos procesos físicos y químicos en sistemas naturales y tecnológicos. La presión osmótica se manifiesta en membranas semipermeables, que permiten la permeación selectiva de ciertas moléculas o iones según su tamaño, forma, polaridad o carga.