по Manu León 4 лет назад
741
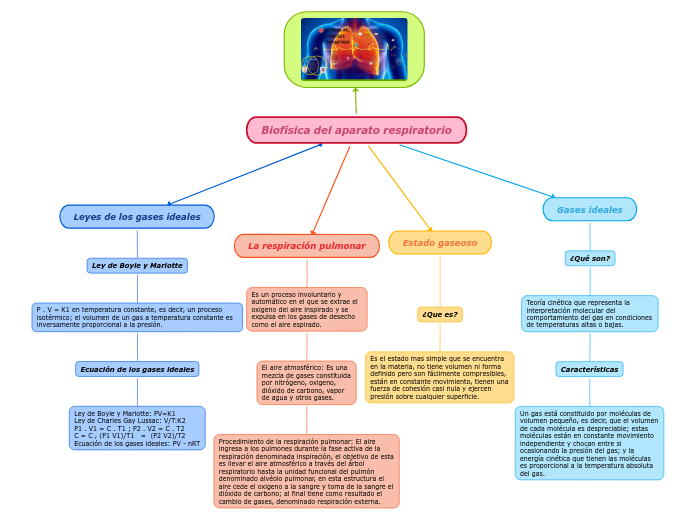
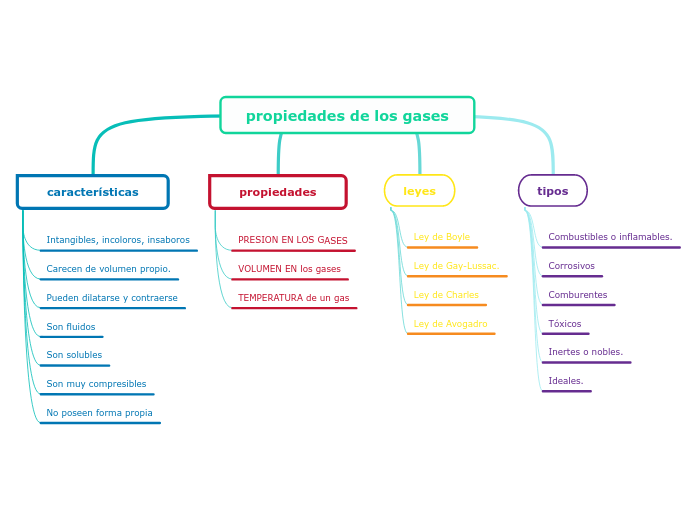
Biofísica del aparato respiratorio
La respiración pulmonar es un proceso automático que permite la obtención de oxígeno del aire y la eliminación de dióxido de carbono. El aire atmosférico, compuesto por varios gases, es inhalado y llevado a los alvéolos pulmonares, donde ocurre el intercambio gaseoso entre el oxígeno y el dióxido de carbono.