av simon fischer för 2 årar sedan
248
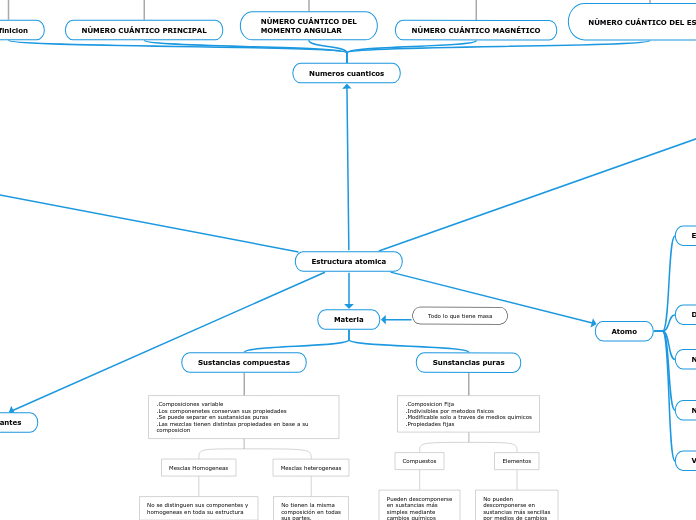
Estructura atomica
La estructura atómica y la tabla periódica son fundamentales para entender las propiedades de los elementos. Los metales tienen pocas capas de electrones externos y forman cationes al perderlos, creando compuestos iónicos con no metales.