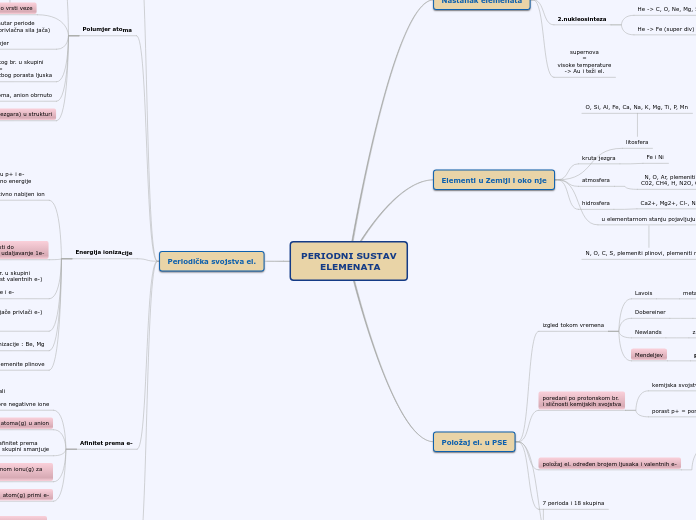
PERIODNI SUSTAV
ELEMENATA
Periodička svojstva el.
Elektronegativnost
razlika u elektronegativnosti određuje veze
nepolarna / polarna kovalentna ili ionska
velika E ionizacije i afinitet = velika
elektronegativnost- nemetali
cbrnuto za metale
sposobnost jezgre jednog el. da privlači e- iz veze s drugim el.
Afinitet prema e-
E koja se oslobađa ili veže kada atom(g) primi e-
E koju je potrebno dovesti negativno nabijenom ionu(g) za odvajanje e-
porast protonskog br. afinitet prema
e- u periodi poveća, u skupini smanjuje
E koja oslobodi pri prijelazu neutralnog atoma(g) u anion
nemetali
=
veliki afinitet - lako tvore negativne ione
Energija ionizacije
jaka E ionizacije: plemenite plinove
izuzetci porasta E ionizacije : Be, Mg
porast protonskog br. u periodi (jezgra jače privlači e-)
=
jača sila jezgre i e-
porast protonskog br. u skupini
(povećava udaljenost valentnih e-)
=
smanjena sila jezgre i e-
najmanja E koju je potrebno dovesti do
izoliranog atoma / iona u plinovitom staju za udaljavanje 1e-
privlačne sile između p+ i e-
-> dovođenjem dovoljno energije
=
e- odvaja od jezgre - pozitivno nabijen ion
smanjenjem broja e-
=
povećava E ionizacije
pozitivnoj čestici teže
oduzet e- nego neutralnoj
naboj ovisi koliko el. atoma otpustio
Polumjer atoma
polovica razmaka dvaju susjednih atoma (jezgara) u strukturi
kation manji radijus od početnog atoma, anion obrnuto
porast protonskog br. u skupini
=
porast polumjera zbog porasta ljuska
porast protonskog br. unutar periode
raste pozitivan naboj jezgre (privlačna sila jača)
=
smanjen polumjer
ovisi o vrsti veze
metalna, ionska, kovalentna
bez oštre granice = nema pravi polumjer
MIJENJAJU PERIODIČKI
Položaj el. u PSE
izoelektronske čestice
jednak br. e-, jednaka konfiguracija
7 perioda i 18 skupina
metali, nemetali i polumetali
položaj el. određen brojem ljusaka i valentnih e-
dublet i oktet stabilne konfiguracije
oktet - plemeniti plinovi
poredani po protonskom br.
i sličnosti kemijskih svojstva
porast p+ = porast e-
broja valentnih e- mijenja periodički (0-8)
=
mijenjanje svojstava el.
kemijska svojstva ovise o broju valentnih e-
izgled tokom vremena
Mendeljev
periodni zakon
poredak po relativnim atomskim
masama u grupe sličnih svojstva
Newlands
zakon oktava
Dobereiner
trijade
Lavois
metali i nemetali
Elementi u Zemlji i oko nje
u elementarnom stanju pojavljuju
N, O, C, S, plemeniti plinovi, plemeniti metali
hidrosfera
Ca2+, Mg2+, Cl-, Na+, K+...
atmosfera
N, O, Ar, plemeniti plinovi,
C02, CH4, H, N2O, O3, CO...
kruta jezgra
Fe i Ni
litosfera
O, Si, Al, Fe, Ca, Na, K, Mg, Ti, P, Mn
Nastanak elemenata
supernova
=
visoke temperature
-> Au i teži el.
2.nukleosinteza
He -> Fe (super div)
He -> C, O, Ne, Mg, Si (crveni div)
1.nukelosinteza
tri prvobitna elementa: H, He i Li
nekoliko stotina tisuća godina
-> atomi H i He
1-3 min. od Velikog praska
-> neutroni i protoni
=> jezgre deuterija, tricija i He