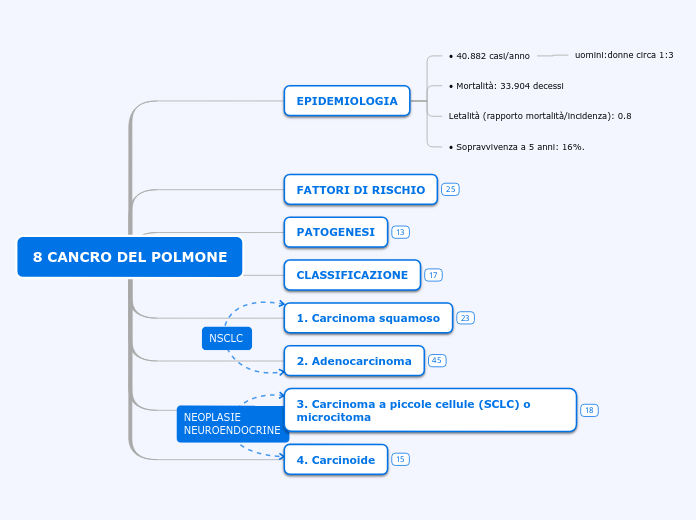
8 CANCRO DEL POLMONE
4. Carcinoide
Dall’indagine istologica è possibile distinguere il carcinoide di forma tipica da quello di forma atipica:
(n.b. Come già accennato precedentemente, la necrosi, se presente, non è generalmente un segno prognostico favorevole, perché è segno di un indice replicativo delle cellule tumorali molto alto; questo determina un’incapacità da parte dei vasi sanguigni di apportare il nutrimento necessario alla sopravvivenza delle stesse).
Ø Atipica se si hanno tante mitosi (2-10 mitosi per 2 mm2), con necrosi
Ø Tipica se si hanno poche mitosi (<2 mitosi per 2 mm2), senza necrosi
Essendo il tumore di natura neuroendocrina, come tutte le ghiandole endocrine non presenterà dotti, ma le cellule necessiteranno di una buona vascolarizzazione per riversare nei vasi il loro secreto, successivamente riscontrabile nel torrente sanguigno
I vasi sono distinguibili nell’immagine in alto a sx grazie alla struttura (alcuni stellariformi, altri più regolari, ma sempre con una parete endoteliale ben visibile) ed alla presenza di emazie
(colorate in fucsia) al loro interno.
Nell’immagine sulla destra, forte ingrandimento, i capillari sono colorati in bianco nello stroma tra gli elementi cellulari.
Nell’immagine in basso a sinistra si osserva invece la colorazione con un tipico marcatore neuroendocrino, già precedentemente citato, la cromogranina A.
Questo tumore cresce lentamente senza inizialmente dare segni di sé, finché non compaiono sintomi quali, ad esempio, la tosse.
Il modello che lo descrive è quello della crescita ad iceberg: una componente posta fuori dall’acqua (la parte del tumore che sporge nel lume del bronco), un colletto ristretto ed una terza parte sommersa (parte del tumore che cresce dentro, con margini abbastanza definiti, proprio perché se anche è in grado di infiltrare, non lo fa distruggendo i tessuti).
Questo perché cresce al di sotto della mucosa senza infiltrare in maniera distruttiva (come farebbe, ad esempio, un carcinoma squamoso) e senza necrotizzare, tant’è che la mucosa rimane integra.
L’immagine in alto rappresenta un carcinoide osservato all’indagine broncoscopica, probabilmente a cavallo di una diramazione bronchiale, che crea pertanto una sub-ostruzione con bronchiectasia a valle.
Esiste anche l’atelettasia da compressione, come in caso di pneumotorace, in cui l’ingresso di aria nella cavità pleurica determina un impedimento all’espansione polmonare con collasso alveolare.
Un’altra conseguenza potrebbe essere l’atelettasia da ostruzione: l’aria non raggiunge più gli alveoli a causa dell’ostruzione, per cui l’aria presente nel parenchima ad un certo punto viene riassorbita e gli alveoli collassano.
Fa parte molto più frequentemente del compartimento centrale, ma può riguardare anche il compartimento periferico.
Se è della forma tipica e viene rimosso chirurgicamente, in genere il paziente guarisce. Se la forma è atipica, il discorso è invece un po’ più complesso.
Si tratta di un tumore neuroendocrino maligno, ma comunque più blando rispetto agli altri descritti.
3. Carcinoma a piccole cellule (SCLC) o microcitoma
Microscopicamente
Essendo questo tumore di origine neuroendocrina, è positivo ai marcatori neuroendocrini come quello qui utilizzato (CD56 o NCAM).
In questa immagine i nuclei sono azzurri, mentre il citoplasma è tinto di marrone (il marrone è tipico di una colorazione immunoistochimica, in quanto la diaminobenzidina, il cromogeno più utilizzato che lega il complesso antigene-anticorpo eventualmente formatosi, è di questo colore).
In questa immagine si mette in evidenza un altro aspetto di queste cellule neoplastiche, che appaiono allungate e con una fessura al centro, ricordando il chicco d’avena e prendendo il nome di oat cells o cellule a chicco d’avena.
Indicato anche con il termine di “oat-cell carcinoma”.
In basso a sinistra è anche visibile un’area di necrosi, mentre più in alto si può notare un crash artifact (artefatto da schiacciamento) dovuto all’uso della pinza bioptica durante il prelievo del campione.
Queste lesioni sono tipicamente molto fragili perché le cellule che le compongono hanno solo un sottile velo di citoplasma a proteggere il nucleo, quindi è facile ritrovare questo tipo di artefatti che se molto estesi possono rendere difficile la diagnosi.
Ad un certo punto, la fonte sanguigna non sarà più all’altezza di nutrirle ed esse andranno incontro a necrosi.
Questo tumore presenta una necrosi parcellare, che caratterizza solo alcune aree sparse della lesione.
L’indice replicativo stabilito dall’osservazione del reperto istologico da parte dell’anatomopatologo, che conta il numero di mitosi visibili, ma anche tramite una specifica colorazione che prende il nome di Ki-67 (approfondita più avanti) e mette in evidenza il ciclo replicativo delle cellule.
In questa immagine saltano all’occhio tre vasi sanguigni (in rosa), responsabili del nutrimento del tumore, ma è chiaro che lo stroma è veramente poco, mentre la componente cellulare è prevalente.
Questo perché il microcitoma è un tumore ad elevatissimo indice replicativo
Ø i nuclei sono giustapposti l’un l’altro fino a formare una struttura a catena tipica che prende il nome di colonna vertebrale in quanto ricorda l’articolazione delle vertebre tra loro. Il fenomeno è indicato come molding dei nuclei.
Ø la cromatina è dispersa e viene indicata con il
termine “cromatina sale e pepe”
Per queste caratteristiche sono spesso indicate con il nome di cellule linfocito-simili, però a differenza dei linfociti che sono tipicamente delle cellule libere, queste cellule tumorali tendono ad aggregarsi in quanto sono di derivazione epiteliale.
Ø nucleo molto grande (il nucleo si colora in blu)
Ø hanno poco citoplasma
Ø cellule piccole (da questo deriva il nome del tumore), con diametri di 7-10 μm;
tipicamente caratterizzato da un precoce impegno dei linfonodi ilari o
intraparenchimali, perché diffonde nei vasi linfatici peribronchiali. Per questo motivo, spesso i microcitomi vengono confusi con i linfomi.
I linfonodi sono indicati dalle frecce, ed appaiono neri a causa dell’antracosi.
Macroscopicamente:
Può dar vita a noduli satelliti.
aspetto di un tessuto lardaceo o cerebroide, perché somiglia al tessuto nervoso dell’encefalo.
tumore del compartimento centrale.
Ha la caratteristica di nascere a livello centrale (in corrispondenza dei bronchi) ed espandersi anche in periferia.
È la neoplasia del polmone più aggressiva.
- Citocheratina
= Carcinoma squamoso
La Citocheratina non è un marcatore specifico, perché è presente in tutti i carcinomi. Per distinguere le due forme è quindi necessario utilizzare gli altri marcatori, soprattutto quando la differenziazione del polmone è scarsa e la morfologia non aiuta con la diagnosi.
- Napsin-A +, marcatore citoplasmatico
- TTF-1 +, marcatore nucleare
Pattern di crescita microscopici:
Ø Enterico
assomiglia ad un carcinoma del colon, pertanto sarà necessario fare diagnosi differenziale tra una metastasi a partenza dal colon ed un tumore primario del polmone.
Ø Lepidico
Se cresce, può diventare uno “pneumonia-like”, perché la polmonite è caratterizzata da un addensamento del parenchima che sarà dato dall’accumulo di cellule a livello alveolare.
Anche nelle polmoniti da Covid si riscontra questo aspetto definito “ad albero in fiore”, con iperplasia degli pneumociti di II tipo. Mentre nel Covid questo processo ha un’evoluzione rapida (il paziente diventa dispnoico dopo pochi giorni e peggiora in poco tempo), nel caso del tumore a crescita lepidica il processo è molto più lento
Essendo questo aspetto condiviso sia dalle polmoniti che dai tumori, è uno dei pattern più difficili da diagnosticare.
Può essere muco secernente (il citoplasma delle cellule appare chiaro, come in tutte le cellule mucipare, come nel caso dell’immagine sulla sinistra), oppure non muco secernente.
Come visibile nell’immagine sulla sinistra, questo tumore cresce lungo le pareti degli alveoli. La conseguenza più temibile è l’invasione degli spazi aerei, come visibile nell’immagine sulla destra.
Spesso vengono riscontrate cellule tumorali negli alveoli a seguito di un intervento chirurgico, e in questo caso si discute se esse derivino da questo tipo di processo oppure se siano presenti a causa della manipolazione da parte del chirurgo).
Ø Micropapillare
Fa delle micropapille. È stato dimostrato che si tratti di una variante molto aggressiva.
Ø Papillare
Le papille sono strutture che contengono l’asse connettivo-vascolare, rivestite in questo caso da cellule cilindriche di natura ghiandolare. Si ritrovano sia in altri adenocarcinomi che in semplici carcinomi (non ghiandolari).
Ø Solido
è l’evoluzione delle forme scarsamente differenziate, perciò è un pattern tipico degli stadi avanzati
Ø Acinare
possiamo evidenziare la differenza tra una forma più differenziata, sulla sinistra, ed una scarsamente differenziata, sulla destra, che è molto più difficilmente diagnosticabile in quanto le strutture acinari tipiche non sono ben distinguibili.
Questo pattern si caratterizza per la formazione di strutture ghiandolari a forma di acini.
Ø Adenocarcinoma minimamente invasivo (MIA)
solo sapere che esiste.
Ø Adenocarcinoma in situ (AIS)
Talvolta è possibile riscontrarlo come reperto occasionale durante indagini radiologiche svolte per altri motivi. Va fatto ovviamente uno studio istologico per capire la natura della lesione visibile tramite le tecniche di imaging.
In questi casi il tumore è “preso in tempo” e può essere più facilmente resecato.
Si distingue dalla forma MIA a seconda dell’estensione della crescita microscopica (qui leggermente minore).
A livello istologico, l’adenocarcinoma è un tumore ghiandolare, che si organizza in ghiandole immerse in uno stroma, le cui cellule perdono la polarità, a seconda del grado di differenziazione.
Pattern di crescita macroscopici:
Ø Pseudo-mesotelioma, che ricorda il mesotelioma e si presenta come una “cotenna pleurica”, che non sta dentro il parenchima polmonare, ma sembra quasi stare solo al di fuori. Dà una sorta di ispessimento pleurico.
Ø Endobronchiale, più simile al carcinoide e al carcinoma squamoso che spesso hanno questo tipo di crescita
Ø Noduli bilaterali multipli, che mimano delle metastasi
Ø “Pneumonia-like”
Questa somiglianza è problematica, perché potrebbe portare a scambiare il tumore per un “semplice” quadro infettivo, non impostando pertanto la corretta terapia e facendo peggiorare
il quadro del paziente.
Somiglia ad un quadro di polmonite, sia alla radiografia in cui si riscontra un addensamento, sia a livello macroscopico con noduli confluenti e qualche nodulo satellite.
Ø Nodulo periferico, la forma più frequente.
È molto facile che il nodulo periferico affiori sulla superficie pleurica (nella fase avanzata) dando vita ad un versamento neoplastico nella cavità pleurica, perché andando a comprimere la pleura parietale il sistema di drenaggio non è più ben funzionante, con conseguente accumulo di liquido.
In seguito al drenaggio, previa centrifugazione si ricercano nel liquido eventuali cellule neoplastiche (in laboratorio).
In questo caso è necessario drenare il versamento prima che diventi massivo per evitare un’atelettasia da compressione, che si manifesta con dispnea di grado sempre più elevato.
In alcuni casi, (immagine a destra), la cicatrice è così importante da dare una retrazione della pleura o un ispessimento pleurico determinando un pattern pseudo-mesoteliomatoso
all’estrema periferia, in contatto con la pleura viscerale. Nell’immagine sulla sinistra si nota una lesione con margini irregolari che al centro non presenta necrosi
(n.b. il colore nero è dovuto all’antracosi centro-lobulare, probabilmente si tratta del polmone di un fumatore), ma piuttosto, forse, una cicatrice (si parla di “cicatrice stellata” per la sua forma).
il più frequente. Tipico del compartimento periferico.
Generalmente ha bordi irregolari e non si riscontrano aspetti necrotici (addirittura si parla di “tumore su cicatrice”, in quanto si ha una sclerosi dello stroma piuttosto che una necrosi).
Marcatori immunoistochimici
Il carcinoma squamoso non ha un marcatore citoplasmatico specifico.
- Citocheratina +
- P63 o P40 + (molto simili), marcatori nucleari
All’indagine istologica, la necrosi appare come materiale indistinto (nella parte destra), man mano che ci si avvicina alla parete della lesione (alla parte sinistra) si rendono nuovamente visibili cellule neoplastiche con le caratteristiche
specifiche del carcinoma squamoso (cheratinizzazione, spine, nuclei ipercromatici ad inchiostro di china).
Il carcinoma è definito “squamoso” in quanto il suo aspetto globale ricorda quello dell’epidermide (cute).
L’epitelio bronchiale non è però un epitelio squamoso. Questo tipo di tumore potrà svilupparsi:
Ø nella maggior parte dei casi, a partire da una metaplasia squamosa dell’epitelio bronchiale, reversibile, che evolve poi in displasia, quasi totalmente irreversibile, in quanto caratterizzata dall’acquisizione delle alterazioni genetiche delle prime fasi del processo di cancerogenesi.
Questo passaggio rappresenta infatti la fase critica per lo sviluppo del tumore. La displasia evolve infatti verso il carcinoma in situ, che può diventare carcinoma invasivo se supera la membrana basale. Questa serie di eventi avvengono in un periodo di tempo piuttosto lungo;
Ø A partire dalle cellule basali dell’epitelio, che mantengono caratteri di staminalità e possono pertanto dar vita anche a cellule squamose;
livello microscopico, le cellule neoplastiche di derivazione epiteliale sono caratterizzate da:
• Nuclei ipercromatici ed irregolari spesso definiti “ad inchiostro di china” proprio per la colorazione scura.
• Cheratinizzazione La cheratina è una proteina, costituente fondamentale dei filamenti intermedi delle cellule epiteliali, soprattutto della cute.
Queste tendono a colmarsi di cheratina nel corso del proprio ciclo vitale fino a ridursi a delle lamelle di cheratina, formate da cellule morte prive di nucleo. All’interno del tumore avviene lo stesso, infatti nel disegno sulla sinistra, sono rappresentate in basso a destra delle lamelle. È da ricordare che la cheratina rende le cellule che la contengono rigide ed il loro citoplasma denso;
• Ponti intercellulari simili a “spine” che si portano tra le cellule (si usa, infatti, il termine di epitelio spinoso). A questo livello si evidenziano giunzioni desmosomiali;
caratteristica fondamentale dei carcinomi squamosi è che sono tendenti alla necrosi
In questa immagine è evidenziabile una cavitazione tipica di questo tipo di tumore, spesso definita come cancro-ascesso, si evidenzia una struttura caratterizzata da una zona addensata circondante una cavitazione e non si è in grado di fare diagnosi differenziale con certezza (non si distingue bene se sia un ascesso, un cancro- ascesso, una lesione tubercolare).
Al suo interno potrebbe essere presente pus a causa di una superinfezione, ma soprattutto sono presenti cellule neoplastiche necrotiche.
Inserendo un ago tramite i bronchi o dall’esterno del polmone per prelevare materiale dal tumore, questo potrebbe non essere diagnostico se viene campionata solo la componente centrale della lesione, proprio perché necrotica.
Invece, svolgendo il prelievo più vicino alla parete solida aumenta la possibilità di incontrare neoplasia vitale.
Il tumore, visibile alla broncoscopia, è aggettante nel lume del bronco, infiltrato e parzialmente ostruito. In questo modo si determina un blocco al passaggio delle secrezioni con formazione di un tappo di muco e conseguente bronchiectasia a valle.
in generale le arterie vengono difficilmente infiltrate da parte
delle neoplasie, al contrario dei vasi linfatici e delle vene. Questo perché la spessa parete arteriosa si comporta come un muro, bloccando una possibile “infiltrazione a tutto spessore”. Al contrario, le cellule neoplastiche dovranno farsi spazio tra la tonaca avventizia e la tonaca media determinando un’infiltrazione parziale, spesso circondando “a manicotto” l’arteria.
tumore dentro al bronco, caratterizzato da alcune aree centrali
colliquate, ovvero andate incontro a necrosi di tipo colliquativo.
In questo caso c’è stata anche un’infiltrazione dell’arteria polmonare (anche se quello che si osserva all’interno del vaso è molto probabilmente un trombo).
Macroscopicamente la lesione del caso con aspetto lardaceo, biancastro e margini irregolari.
Nell’immagine radiologica evidente che sia vicino alle strutture mediastiniche.
È un tumore epiteliale del compartimento centrale.
CLASSIFICAZIONE
Schema classificazione
queste classificazioni sono semplificative, ma in realtà i tumori sono molto eterogenei, per cui si potrebbero riscontrare forme miste
nuova classificazione
Tutte queste forme di tumore sono accomunate dal fatto di risultare positive ai marcatori neuroendocrini (cromogranina, sinaptofisina, NSE ovvero neuron-specific enolase, CD56 o NCAM).
Grazie all’indagine morfologica ed immunoistochimica si riesce a distinguere il tipo di tumore.
piuttosto che utilizzare il termine SCLC si parla di carcinoma neuroendocrino a piccole cellule (SCNC ovvero small-cell neuroendocrine cancer).
Oltre a questo e al Carcinoide, esiste anche una variante neuroendocrina a grandi cellule (large-cell neuroendocrine cancer).
tumori primitivi maligni principali
Nel compartimento periferico predomina
quindi nei fumatori possono svilupparsi tutte e tre le forme, mentre nei non fumatori predomina l’adenocarcinoma.
Adenocarcinoma
Nel compartimento centrale predominano
SCLC e Carcinoma squamoso
• NEOPLASIE NEUROENDOCRINE
4. Carcinoide (tipico o atipico)
3. Carcinoma a piccole cellule (SCLC ovvero small-cell lung cancer) o microcitoma
• NON A PICCOLE CELLULE (NSCLC ovvero non-small-cell lung cancer)
2. Adenocarcinoma
1. Carcinoma squamoso
PATOGENESI
molto spesso, (soprattutto del compartimento periferico), sono letali in quanto vengono diagnosticati in fase avanzata.
talvolta possono svilupparsi nel compartimento centrale (albero bronchiale e parenchima più prossimale), talvolta
nel compartimento periferico (parenchima polmonare periferico, a partire dai bronchioli respiratori laddove scompare il rivestimento cartilagineo, quindi tutta la porzione distale del polmone).
i cancerogeni vanno ad agire sull’intero polmone,
fattori ancora ignoti, responsabili dello sviluppo del tumore nei never smokers sembra che vadano ad agire unicamente sul compartimento periferico.
Nel compartimento periferico come cellule target si distinguono le cellule di Clara, le cellule cigliate, e nell’alveolo vero e proprio gli pneumociti di II tipo, producenti surfactante, e quelli di I tipo, molto sottili, che mediano gli scambi respiratori.
Nel compartimento centrale si riscontra la mucosa bronchiale il cui epitelio è caratterizzato da cellule cigliate, cellule secernenti muco e cellule basali che continuamente rinnovano l’epitelio. Tra queste sono sparse anche cellule neuroendocrine.
Gli oncogeni driver del tumore del polmone sono numerosi. Oggi si tende il più possibile a fare un sequenziamento completo del DNA tumorale per individuare quali mutazioni siano espresse dal tumore, sia per comprenderne meglio la patogenesi, sia per impostare delle terapie target sempre più specifiche.
kRAS = former/current smokers.
Mutazione dell’EGFR identifica EGFR-mutant non-small-cell lung cancer = sottocategoria di tumori definita oncogene-driven cancer
I pazienti portatori di questa mutazione giovano di terapie con inibitori delle tirosin chinasi (TKIs).
EGFR e ALK più frequenti rispettivamente nei never smokers
Il carcinogeno agisce sempre su tutto l’albero bronchiale, perciò non è raro riscontrare lesioni multiple primitive tipiche del quadro della field cancerogenesis (cancerogenesi di campo).
Proprio per questo, talvolta è difficile definire se una lesione riscontrata sia la metastasi di un’altra o se si tratti di due tumori primitivi separati, ad esempio.
un accumulo di alterazioni driver, ovvero di mutazioni che si
susseguono una dopo l’altra secondo il modello della cancerogenesi multistep, così come per molte altre neoplasie.
FATTORI DI RISCHIO
• ETÀ
rischio di sviluppare il cancro al polmone con l’avanzare
dell’età rispettivamente nei current smokers (soggetti che fumano attualmente), nei former smokers (ex fumatori) e nei never smokers (mai fumatori).
• ESPOSIZIONE A:
Sostanze tossiche ad es: amianto, radon, metalli pesanti.
Inquinamento atmosferico
nei never smokers
principali fattori di rischio
• Carcinogeni ambientali soprattutto per la popolazione maschile.
• Carcinogeni domestici soprattutto per la popolazione femminile;
• HPV ceppi 16/18, gli stessi responsabili del carcinoma squamoso della cervice uterina.
Oggi si tende a non permettere il parto per via naturale a donne portatrici di HPV, in quanto potrebbero infettare il feto al momento dell’espulsione e questo potrebbe determinare l’instaurarsi di un’infezione latente, responsabile col passare degli anni dello sviluppo di un cancro al polmone;
• Fattori genetici raddoppiano il rischio rispetto alla popolazione non esposta “2-fold”;
alcuni soggetti definiti “rapidi riparatori” riparano in poco tempo il danno e hanno quindi un basso rischio di sviluppo del cancro, mentre altri soggetti definiti “lenti riparatori” il cui apparato di difesa enzimatico non è al massimo della funzionalità, hanno un alto rischio di sviluppare il tumore.
• Carbone/legno bruciati aumentano di 2.5 volte il rischio rispetto alla popolazione non esposta “2.5-fold”
• Olio dei “cooking vapours” raddoppia il rischio rispetto alla popolazione non esposta “2.1-fold”
• Fumo passivo aumenta di 1.2 volte il rischio rispetto alla popolazione non esposta (“1.2-fold”)
incidenza più alta nei paesi asiatici,
più frequente tra le donne
fumo di sigaretta = carcinogeno di gruppo 1 (sicuramente carcinogeno)
L’80% dei tumori del polmone compaiono in pazienti fumatori (smokers), mentre il restante 20% in pazienti mai fumatori (never smokers)
non tutti i fumatori si ammalano di cancro al polmone, e al contempo i non fumatori hanno comunque un rischio di sviluppare cancro al polmone collegato ad altri fattori
rischio è in funzione della durata
Dopo i 50 anni il picco di rischio di sviluppo diventa esponenziale proprio per l’esposizione prolungata per anni al fumo di tabacco
cancro si sviluppa dopo un numero di sigarette pari a 50
pacchetti/anno
contiene una serie di sostanze chimiche nocive (aldeidi, chetoni, nicotina, monossido di carbonio, benzopirene) e più di 60 mutageni.
EPIDEMIOLOGIA
• Sopravvivenza a 5 anni: 16%.
Letalità (rapporto mortalità/incidenza): 0.8
• Mortalità: 33.904 decessi
• 40.882 casi/anno
uomini:donne circa 1:3