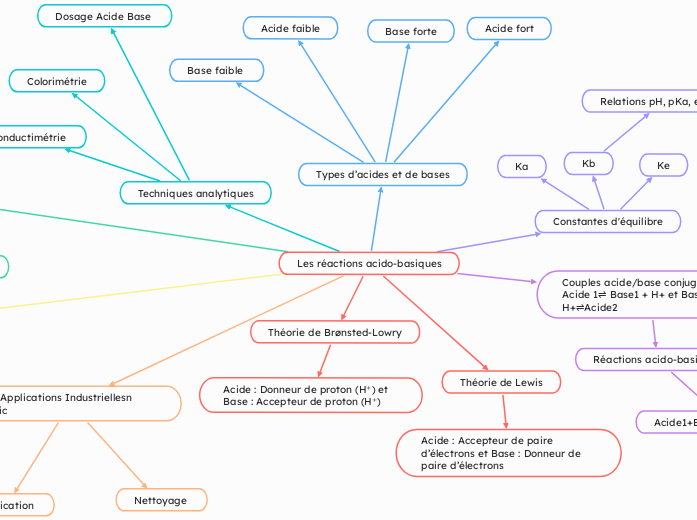
Les réactions acido-basiques
Théorie de Lewis
Acide : Accepteur de paire d’électrons et Base : Donneur de paire d’électrons
Applications Environnementales
Pluies acides
Traitement des eaux
MaiApplications Industriellesn topic
Nettoyage
Fabrication
Applications Pratiques
Diagnostic
Neutralisation
Techniques analytiques
Colorimétrie
Conductimétrie
Dosage Acide Base
Types d’acides et de bases
Base faible
Acide faible
Base forte
Acide fort
Constantes d'équilibre
Ke
Kb
Relations pH, pKa, et pKb
pH=-log(H+) et pKa+pKb=14
Ka
Couples acide/base conjugué :
Acide 1⇌ Base1 + H+ et Base2+ H+⇌Acide2
Réactions acido-basiques
Acide1+Base2⇌Acide2+Base1
Théorie de Brønsted-Lowry
Acide : Donneur de proton (H⁺) et Base : Accepteur de proton (H⁺)