QUIMICA ANALITICA
COEFICIENTE DE ACTIVIDAD
Es coeficiente de actividad es un
número que expresa el factor de
actividad química de una sustancia
en su concentración molar.
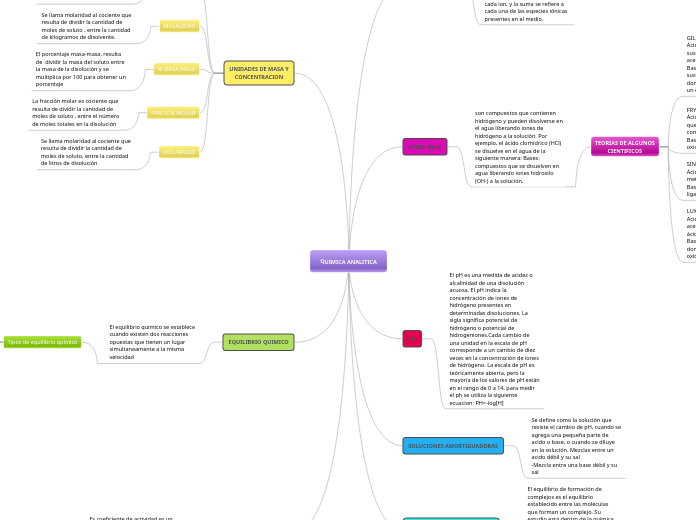
EQUILIBRIO QUIMICO
El equilibrio químico se establece
cuando existen dos reacciones
opuestas que tienen un lugar
simultaneamente a la misma
velocidad
Tipos de equilibrio químico
ION COMUN
El efecto del ion común establece
que en una solución química en
donde varias especies se asocian
de forma reversible entre sí por un
proceso de equilibrio,
incrementando la concentración de
cualquiera de sus componentes
disociados mediante la adición de
otro químico que también lo
contenga causará un incremento
en la cantidad de asociación
ION DIVERSO
También llamado, efecto salino,
se detecta por el aumento de la
solubilidad de una sal poco o muy
soluble, cuanto mas insoluble sea
la sal primeria, mas notable será el
efecto salino
LEY DE CHANTELIER
El ion común no contradice esta
ley, que se basa en que cuando un
sistema experimenta una alteración
(como un cambio en la
concentración, temperatura, o
presión), este responderá y se
volverá a establecer un nuevo
estado de equilibrio
EQUILIBRIO ETEROGENEO
Los equilibrios heterogéneos, son
las lentos que los equilibrios en
solución, aquí los solidos no
cuentas en la constante.
EQUILIBRIO HOMOGENEO
El equilibrio es un estado en el que
no se observa cambios durante el
tiempo transcurrido. Cuando una
reacción química llega al estado de
equilibrio, las concentraciones de
reactivos y productos permanecen
constantes en el tiempo, sin que se
produzca cambios visibles en el
sistema
UNIDADES DE MASA Y
CONCENTRACION
MOLARIDAD
Se llama molaridad al cociente que
resulta de dividir la cantidad de
moles de soluto, entre la cantidad
de litros de disolución
FRACION MOLAR
La fracción molar es cociente que
resulta de dividir la cantidad de
moles de soluto , entre el número
de moles totales en la disolución
% MASA MASA
El porcentaje masa-masa, resulta
de dividir la masa del soluto entre
la masa de la disolución y se
multiplica por 100 para obtener un
porcentaje
MOLALIDAD
Se llama molaridad al cociente que
resulta de dividir la cantidad de
moles de soluto , entre la cantidad
de kilogramos de disolvente.
NORMALIDAD
Se determina la normalidad al
dividir el número de equivalentes
entre los litros de disolución.
EQUILIBRIO DE FORMACION DE
COMPLEJOS
El equilibrio de formación de
complejos es el equilibrio
establecido entre las moléculas
que forman un complejo. Su
estudio está dentro de la química
analítica. las reacciones de
formación de complejos no son
más que equilibrios que se
establecen entre un ácido de Lewis
y una base de Lewis, que en esta
rama de la química se conocen
como ligandos.
SOLUCIONES AMORTIGUADORAS
Se define como la solución que
resiste el cambio de pH, cuando se
agrega una pequeña parte de
acido o base, o cuando se diluye
en la solución. Mezclas entre un
acido débil y su sal
-Mezcla entre una base débil y su
sal
PH
El pH es una medida de acidez o
alcalinidad de una disolución
acuosa. El pH indica la
concentración de iones de
hidrógeno presentes en
determinadas disoluciones. La
sigla significa potencial de
hidrógeno o potencial de
hidrogeniones.Cada cambio de
una unidad en la escala de pH
corresponde a un cambio de diez
veces en la concentración de iones
de hidrógeno. La escala de pH es
teóricamente abierta, pero la
mayoría de los valores de pH están
en el rango de 0 a 14, para medir
el ph se utiliza la siguiente
ecuacion: PH=-log[H]
ACIDO-BASE
son compuestos que contienen
hidrógeno y pueden disolverse en
el agua liberando iones de
hidrógeno a la solución. Por
ejemplo, el ácido clorhídrico (HCl)
se disuelve en el agua de la
siguiente manera: Bases:
compuestos que se disuelven en
agua liberando iones hidroxilo
(OH-) a la solución.
TEORIAS DE ALGUNOS
CIENTIFICOS
LUX FLOOD
Acidos:son
aceptadores de
ácidos.
Base: son sustancias
donadoras de
oxido.
SINDWICK
Ácidos: son los
metales
Base: son los
ligantes
FRY & STIEGLIZ
Ácidos: esta definida
que los ácidos son
como reductores
Base: son un
oxidante.
GILBERT LEWIS
Ácidos: son las
sustancias que
aceptan electrones.
Base: son aquellas
sustancias que
donan electrones en
un enlace.
FUERZA IONICA
La fuerza iónica, I, de una
disolución es una función de la
concentración de todos los iones
presentes en ella, definida como:
donde 𝐶𝑖 es la concentración
molar de iones presentes en la
disolución, 𝑍𝑖 es la carga de
cada ion, y la suma se refiere a
cada una de las especies iónicas
presentes en el medio.