para descubrir cuando una sustancia tiene alguno de estos dos estados se mira en el numer de oxidacion si este es + es un oxidante y si es - es un reductor.
repaso quimica
The advantages and disadvantages are the pros and cons of a certain topic, that each person considers thoroughly before making a bigger decision.
oxidacion y reduccion
reduccion
este tambien es un tipo e estado en el cual la sustancia gana electrones haci que esta es una carga negativa ya que al ganar electrones su carga negativa se incrementa.
como ejemplo CL- es una sustancia reductora porque tiene carga negativa
un agente reductor es aquel el cual da el electron para que la sustancia se redusca.
oxidacion
este es un tipo de estado en donde la sustancia pierde electrones y ha este se le tiene como una carga positiva ya que al perder carga negativa (de los electrones) disminuye su carga.
como por ejemplo na+ es un a sustancia oxidante ya que tiene carga positiva
un agente oxidante es aquel al cual oxida a una sustancia osea es aquel al cual le quita ese electron para que e oxide la sustancia.
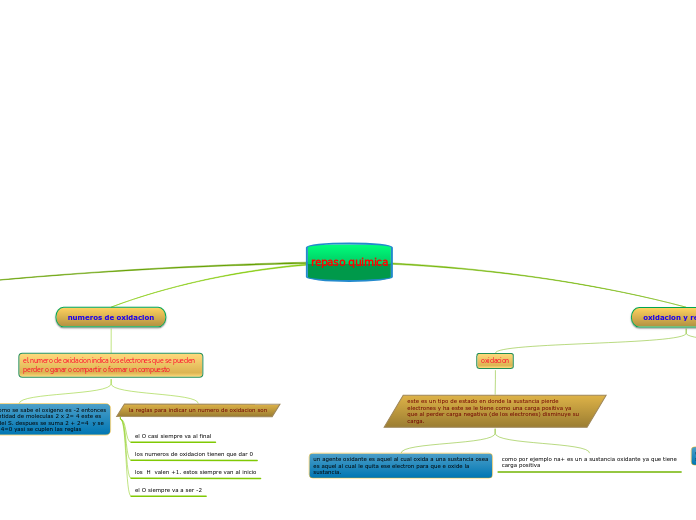
numeros de oxidacion
el numero de oxidacion indica los electrones que se pueden perder o ganar o compartir o formar un compuesto
la reglas para indicar un numero de oxidacion son
el O siempre va a ser -2
los H valen +1. estos siempre van al inicio
los numeros de oxidacion tienen que dar 0
el O casi siempre va al final
por ejemplo en el CO2 como se sabe el oxigeno es -2 entonces multiplico esto con la cantidad de moleculas 2 x 2= 4 este es el numero de oxidacion del S. despues se suma 2 + 2=4 y se restan los resultados 4 - 4=0 yasi se cuplen las reglas
enlaces quimicos
es el conjunto de fuerzas que mantienen unidos a los atomos , iones y moleculas cuando forman distintas agrupaciones estables
enlance ionico
este enlace se debe a una transferencia de electrones de un atomo al otro. en este proceso se pierde y se ganan electrones de un atomo, quedando uno un io positivo al perder, y un ion negativo al perder.
se da entre metales y no metales
>1.7
ganancia o perdida de electrones
enlance covalente
en este enlace su proceso es compatir electrones de un atomo a otro. que se puede presentar en uno solo o en los dos. esto es devido a su electronegatividad. si este es menor a 1.7 que es la diferencia de electronegatividad es un enlace covalente mientras si es mayor es ionico. este tiene dos tipos el polar y apolar.. el polar se debe a la diferencia de electronegatividad que hay un atomo del otro teniendo entre un popolo negativo y uno positivo. mientras en el apolar tiene una diferencia nula.
compartimiento de electrones
<1.7
tiene polar y apolar
se da entre no metales