Configuración Electrónica
Descripción de ubicación de electrones en distintos niveles
de un determinado átomo.
N° cuantico: orbital atómica región del espacio alrededor
del núcleo en el que la posibilidad de encontrar un electrón es máxima.
N° cuantico principal: n° que indica tanto la energía como
distancia entre el electron y el nucleo del atomo, tienen valores de numeros
enteros 1,2,3,4,5,6,7,8 (nivel energético)
N° cuantico secundario: Identifica los subniveles de energía
de electrón y forma orbital
S: 2 electrones p: 6 electrones d: 10 electrones p: 14 electrones.
Adjunto video de como calcular configuración electrónica: https://www.youtube.com/watch?v=aIvZ_pCkKNI
adjunto imagen
https://i0.wp.com/misuperclase.com/wp-content/uploads/2018/06/Moeller-completo.png
La ubicación de los electrones
en los distintos niveles
de energía
Descripción de ubicación de electrones en distintos niveles de un determinado átomo.
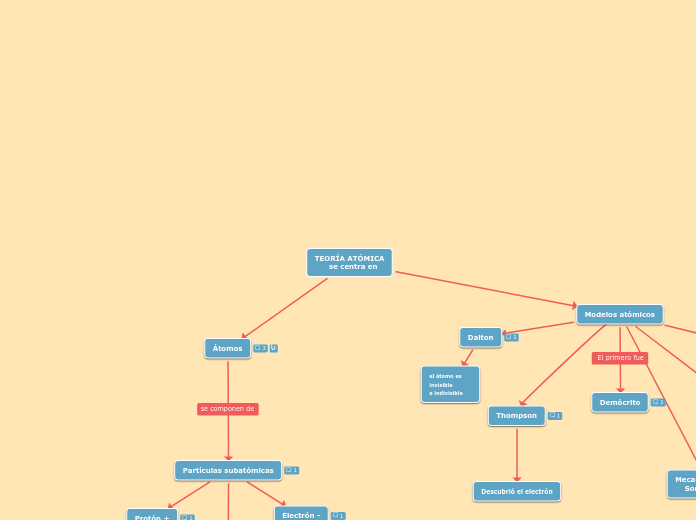
TEORÍA ATÓMICA
se centra en
Modelos atómicos
Mecano-cuántico
Sommerfield
Sustituido por el modelo atómico de Sommerfeld: ya que para
adaptarlo era necesario incluir estos 3 números cuánticos.
L: n° cuantico azimutal
M: n° cuantico magnético
S: n°cuantico de spin
Dentro de un mismo nivel energético existen subniveles
diferentes.
Modelo atomico de shrondinger 1924
Electrones son ondas de materia que se distribuyen en el
espacio según la función de ondas
Los electrones se distribuyen en orbitales que son regiones
del espacio con una alta probabilidad de encontrar un electrón.
Números Cuánticos
orbital atómica región del espacio alrededor del núcleo en el que la posibilidad de encontrar un electrón es máxima.
s
El giro del electrón en su propio eje.
m
cuantico magnético
L
Identifica los subniveles de energía de electrón y forma orbital
n
que indica tanto la energía como distancia entre el electron y el nucleo del atomo, tienen valores de numeros enteros 1,2,3,4,5,6,7,8 (nivel energético)
Böhr
Propuso que electrones se desplazan alrededor del nucleo ,
como un pequeño sistema de energía, donde electrones describen orbitas
circulares estables alrededor del nucleo del átomo sin radiar energía, además
de que electrones solo emiten o absorben energía en los saltos en orbitas, la
distancia de la orbita al nucleo se determina según n° cuantico n=1 n=2 n=3
electrones
se desplazan
alrededor del
núcleo
Rutherford
que el átomo no es compacto si no que esta vacío,
concentrándose la carga positiva en un pequeño núcleo alrededor del cual están los electrones.( descubrió protones con carga positiva)
Átomo vacío
Thompson
Átomo formado por electrones de carga negativa incrustado en una esfera de carga positiva(budín de pasas)
Electrones repartidos de manera uniforme en todo el átomo
Átomo es neutro de esta manera que las cargas negativas de los electrones se compensan con carga positiva.
Descubrió el electrón
Dalton
Materia formada por particulas invisibles indestructibles y pequeñas llamadas atomos
Átomos de mismo elemento son idénticos entre si(masa y propiedades)
Los compuestos están formados por la acción de átomos en proporciones constantes y simples.
el átomo es invisible
e indivisible
Demócrito
Democritus y leucitus: plantearon por primera vez la idea de que todo esta hecho de pequeñas particulas.
Átomos
unidad de partículas más pequeñas, que puede existir como
sustancia simple además de ser unidad básica de toda materia
Numero atómico z: es el numero de protones en el núcleo del
átomo de 1 elemento, representa carga nuclear de átomo a su vez indica numero
de electrones definiendo la configuración electrónica de los átomos.
Ejemplo : Sodio z: 11
protones: 11 electrones:11
Numero masico (A) : representa numero total de neutrones y
protones presentes en el núcleo de un átomo de un elemento.
A: n° de protones + n° de neutrones
A: z +n° rpotones
N° de neutrones : A-Z
Adjunto link de como calcular numero atómico y numero masico
y neutrones: https://www.youtube.com/watch?v=P0hhIIKll58
https://sites.google.com/site/tablaperiodicasuperutil/_/rsrc/1415146003573/home/numero-atomico/bond07%20%20%20%20ju258sarx7ttu5qs.jpg
Adjunto imagen
Partículas subatómicas
subcomposición del átomo
Electrón -
menos masivos y de carga negativa, se mueven en el exterior del núcleo positivo en orbitales.
Neutrón 0
esta partícula no tiene carga, neutra y misma masa que el protón.
Masa atómica
Elementos
Los elementos químicos que alberga la tabla periódica.
Moléculas
conjunto de átomos iguales o diferentes que se encuentran unidos mediante enlaces químicos covalentes y puede ser separado sin que sus propiedades sean alteradas
Enlaces
Existen 3 tipos
corresponde a la fuerza que une o en laza a 2 átomos, sean iguales o distintos en el último nivel energético.
covalente
existen 3 tipos
unión de 2 átomos que comparten uno o más electrones
https://www.areaciencias.com/quimica/imagenes/enlaces-covalentes.jpg
Adjunto imagen
Triple
Cada átomo aporta tres electrones al enlace, es decir, se comparten tres pares de electrones entre dos átomos
doble
enlace covalente doble: Cada átomo aporta dos electrones al enlace, es decir, se comparten dos pares de electrones entre dos átomos.
Estructuras de lewis
cosiste en símbolos químicos que representa el núcleo y electrones internos, juntos con puntos alrededor del símbolo que representan los electrones de valencia.
https://lh3.googleusercontent.com/proxy/-3lMnEdTrIie5E_ghG2aHBGukoKzlNMvcNX3n6IBlEDWYIOiDv65cau4P4sK1JW0mNi0hgAw9BkL76ux9Tp5_DoETi-q8flZbp9cMVdO_JaYV3JKjRlDGeaDukIwpHZw3lV-zGFTkE4iW7WSJ-nnwvQjNOn2IU-TuoqyEQb9RCpEIjeybuyoH1r1bvDJvt5CtiHgkYHAEaEWhQ
adjunto imagen
electrones
solitarios
regla del octeto
puntos
simple
Cada átomo aporta un electrón al enlace, es decir, se comparte un par de electrones entre dos átomos
Dativo
cuando 1 electron de los atomos encabezados aporta 2 electrones del enlace y el otro ninguno.
iónico
se forma por transferencia de electrones del nivel mas externo y resulta por atracción de iones con cargas opuestas.
Ionización
: formación de molecula o átomos con carga eléctrica
Ión
existen 2 tipos
: Es un átomo o un grupo de átomos que tiene carga positiva o negativa.
Anión
Carga neta es negativa debido a un incremento de numero de electrones.
Catión
ion con carga positiva esto quiere decir que se produce perdida de uno o mas electrones
Un conjunto
de átomos
Materia
Todo aquello que tiene masa y ocupa un volumen en el espacio.
Materia esta en constante cambio, transformaciones de 2
tipos:
Física: moléculas mantienen características originales.
Químicas: moléculas cambian convirtiéndose en nuevas
moléculas.
Unidades de medida
Unidades
internacionales
Temperatura
k°
F°
C°
Capacidad
Litro
Mol
(6,02x10^23)
https://i.ytimg.com/vi/r-U4FTXJThg/maxresdefault.jpg
adjunto imagen
ESTEQUIOMETRÍA
Ley de la conservación de la materia
Esto implica
Convervación
del n° de átomos
en los elementos.
Conservación
de la carga
Ecuación equilibrada
https://www.monografias.com/trabajos106/balanceo-ecuaciones-y-nomenclatura-quimica/img1.png
adjunto imagen
Proporciones cuantitativas
Elementos de una reacción
kg
g
Longitud
Mt
Dm
Cm
Mm
Estados
https://sites.google.com/site/losestadosdelamateriakavm/_/rsrc/1510453205455/4-desarrollo/a-definiciones-de-los-estados-de-la-materia/materia-estados.jpg?height=253&width=320
adjunto imagen
Gaseoso
no tiene forma definida cambia libremente de posición
Líquido
no tiene forma definida, puede cambiar de posición
Plasmático
no tiene forma definida se presenta como gas ionizado, solo existe de forma
natural, en el sol y en el espacio sideral.
Sólido
forma definida como madera y cobre no cambian de posición
tipos de sustancias
las cuales son
Mezclas
a su vez existen
Coloidales
polvo flotando en aire, niebla.
Heterogéneas
granito, arena.
Homogéneas
aire,bebidas, perfumes.
Puras
metales,metaloides, no metales, gases nobles.
Propiedades
se dividen en
https://www.monografias.com/trabajos97/materia-monografia/image002.jpg
adjunto imagen
Generales
Volúmen
El volumen es una magnitud definida como el espacio ocupado por un cuerpo
Masa
La masa es una magnitud física fundamental que indica la cantidad de materia contenida en un cuerpo.
Específicas
Punto de
Ebullición
El punto de ebullición es el término que se le da al proceso que se produce al cambio de estado de una materia que pasa de líquido a gaseoso.
Punto de fusión
El punto de fusión es la temperatura a la cual un sólido pasa a líquido a la presión atmosférica.
Densidad
La densidad es una magnitud escalar que permite medir la cantidad de masa que hay en determinado volumen
Protón +
masivos y cargados positivamente en el centro del núcleo del átomo.