af Gabrie Nuñez 4 år siden
334
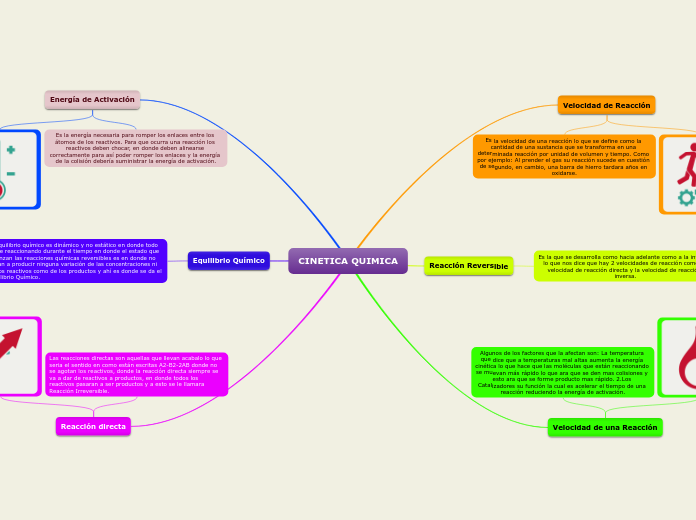
CINETICA QUIMICA
La cinética química es la rama de la química que estudia la velocidad de las reacciones y los factores que la afectan. La temperatura influye significativamente, ya que un aumento en la temperatura incrementa la energía cinética de las moléculas, provocando más colisiones y una formación de productos más rápida.