af Edjane Paz 3 år siden
273
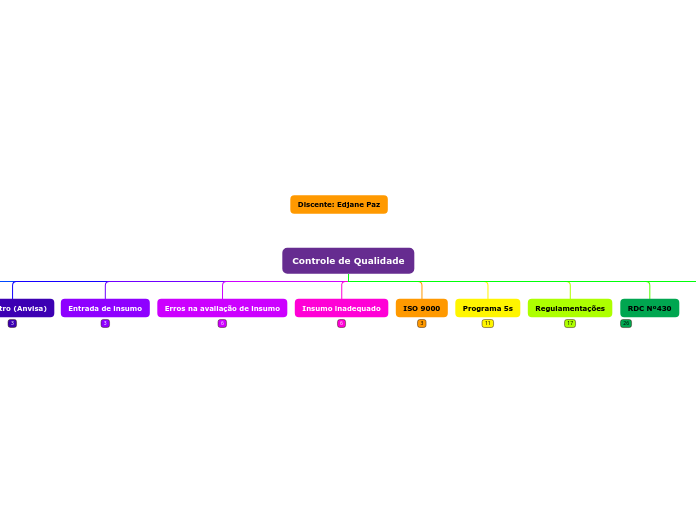
Controle de Qualidade
A regulação estabelece diretrizes rigorosas para o controle de qualidade de medicamentos importados. As empresas importadoras devem realizar análises completas de pelo menos dois lotes anualmente para importações superiores a oito cargas por ano, e a cada dois anos para importações iguais ou inferiores a essa quantidade.