Discente: Edjane Paz
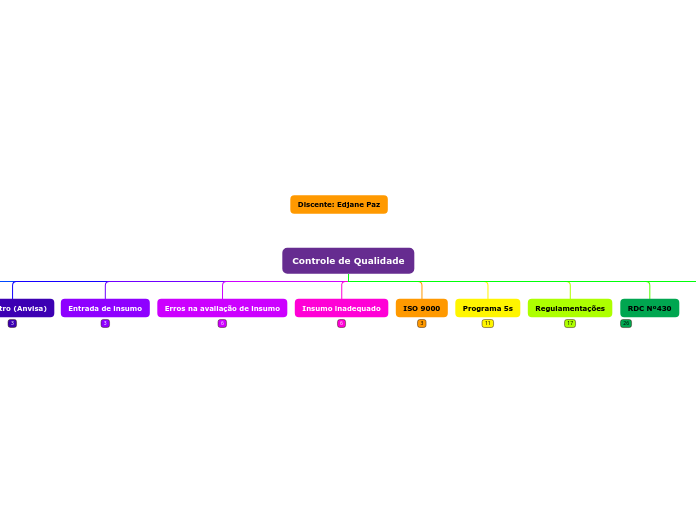
Controle de Qualidade
RDC Nº 257, DE 18 DE DEZEMBRO DE 2018
Art. 5º, VIII - o departamento de Controle de Qualidade da empresa importadora deve realizar todas as análises completas, em conformidade com o registro do medicamento, de no mínimo 2 (dois) lotes anualmente, no caso
de importação acima de 8 (oito) cargas/ano de cada medicamento. Para importação menor ou igual a 8 (oito) cargas/ano recebidas de cada medicamento, devem ser realizadas todas as análises completas, de no
mínimo, 2 (dois) lotes a cada 2 (dois) anos." (NR)
Art. 9º O laboratório próprio da importadora situado em território nacional é responsável pela realização de ensaios completos de controle de qualidade, em conformidade com o registro do medicamento na ANVISA,
para cada carga recebida, lote a lote, de todos os medicamentos importados.
Parágrafo único. Não será permitida a contratação de serviços de terceiros para a realização de ensaios de controle de qualidade, salvo nos casos previstos em legislação vigente." (NR)
Art. 8º Todas as importadoras devem possuir laboratório de controle de qualidade e local de armazenamento próprios, incluindo local específico para armazenamento de amostras de referência. A empresa ainda deve
possuir capacidade técnica e operacional para realizar as atividades necessárias.
Parágrafo único. É vedada a terceirização de armazenamento às empresas que não disponham de local de armazenamento próprio, conforme legislação específica." (NR)
Art. 1º Ficam suspensos por 2 (dois) anos, a contar da data de publicação desta Resolução, o art. 30 e o art. 31 da Resolução da Diretoria Colegiada - RDC n° 234, de 20 de junho de 2018, que dispõe sobre a terceirização de etapas de produção, de análises de controle de qualidade, de transporte e de armazenamento de medicamentos e produtos biológicos, e dá outras providências, a fim de que se realize análise do
impacto regulatório das alterações da Resolução da Diretoria Colegiada - RDC n° 10, de 21 de março de 2011, que dispõe sobre a garantia da qualidade de medicamentos importados.
RDC Nº430
Art. 86. O descumprimento das disposições contidas nesta Resolução constitui infração sanitária, nos termos da Lei nº 6.437, de 20 de agosto de 1977, sem prejuízo das responsabilidades civil, administrativa e penal cabíveis.
Art. 87. Ficam revogadas:
I - a Resolução de Diretoria Colegiada - RDC nº 304, de 17 de setembro de 2019, publicada no Diário Oficial da União de 18 de setembro de 2019; e
II - a Resolução de Diretoria Colegiada - RDC nº 360, de 27 de março de 2020, publicada no Diário Oficial da União de 31 de março de 2020.
Medicamentos Termolábeis
Art. 77. Deve-se minimizar a exposição à temperatura ambiente durante o recebimento e a expedição de medicamentos termolábeis, incluindo, se necessário, a adoção de áreas refrigeradas junto aos espaços de recebimento e expedição.
Art. 72. A terceirização das atividades reguladas nesta norma deve ser precedida pela aprovação do contrato pelo sistema de gestão da qualidade.
Art. 63. São obrigações dos contratantes dos serviços de transporte de medicamentos:
I - qualificar os transportadores;
II - prestar orientação e assistência técnica para os casos de acidentes envolvendo os medicamentos sob transporte, juntamente com o Responsável Técnico da empresa contratada.
Art. 56. Cada operação de recebimento deve verificar e registrar:
I - as condições de transporte e armazenagem aplicáveis, incluindo requerimentos especiais de temperatura, umidade ou exposição a luz;
II - os números de lote, data de validade, e quantidades recebidas frente aos pedidos efetuados e notas fiscais recebidas; e
III - a integridade da carga.
Art. 49. Os medicamentos avariados devem ser retirados dos estoques utilizáveis e armazenados separadamente como reprovados.
Art. 50. As condições de armazenagem dos medicamentos devem seguir as especificações do detentor do registro.
Qualificações e Validações
Art. 40. Equipamentos e sistemas informatizados devem ser qualificados e validados antes do seu uso ou depois de qualquer mudança considerada significativa.
Art. 34. Antes que um medicamento devolvido seja reintegrado ao estoque comercializável, no mínimo os seguintes fatores devem ser registrados e ponderados pelo sistema de gestão da qualidade:
I - o motivo da devolução;
II - as condições de armazenagem e transporte empregadas pelo comprador;
III - a integridade da embalagem secundária original; e
IV - o prazo de validade.
Art. 35. A incapacidade em garantir que o medicamento devolvido se mantém dentro de seus padrões de qualidade deve resultar na rejeição da reintegração.
Art. 36. Os medicamentos objetos de furto, roubo ou outras apropriações indevidas, ainda que tenham sido recuperados, devem ser rejeitados.
Art. 28. O recolhimento deve atender às disposições desta Resolução, sem prejuízo das disposições dadas na Resolução de Diretoria Colegiada - RDC nº 55 de 17 de março de 2005 e suas atualizações.
Art. 29. Cabe ao detentor do registro a coordenação do recolhimento.
Art. 19. A gestão e controle de documentos da qualidade deve dispor as orientações para elaboração, revisão, aprovação, distribuição e controle, treinamento, codificação, guarda e obsolescência dos documentos em
formato físico ou eletrônico.
Art. 20. Os procedimentos operacionais padrão devem ser seguidos e estar disponíveis em seus respectivos locais de trabalho.
Art. 21. Os procedimentos operacionais padrão devem ser mantidos atualizados para que correspondam à prática rotineira.
Art. 22. Os procedimentos operacionais padrão devem ser compreensíveis aos funcionários e não devem apresentar ambiguidades.
Art. 23. Os registros, manuais ou eletrônicos, devem ser prontamente recuperáveis, e devem ser armazenados usando medidas de segurança contra qualquer modificação não autorizada, danos, deterioração ou
perda.
Art. 17. As divergências em relação aos requisitos expressos pelo Sistema de Gestão da Qualidade devem ser interpretadas e tratadas como não conformidades.
Art. 16. As ações do Sistema de Gestão da Qualidade são de responsabilidade de toda a empresa e devem ser exercidas por todos os seus membros.
Art. 15. Os processos que impactam na qualidade dos medicamentos ou dos serviços prestados devem ser mapeados.
Art. 14. O Sistema de Gestão da Qualidade deve cobrir todos os aspectos que influenciam a qualidade dos medicamentos ou dos serviços prestados.
Art. 13. É proibido fumar, comer, beber (com exceção de água potável, que deve estar disponível em um setor específico), mascar, manter plantas, alimentos, medicamentos pessoais, objetos pessoais ou qualquer
objeto estranho ao setor, nas áreas de armazenagem, armazenagem em trânsito, recebimento e expedição.
Art. 12. A sistemática para o treinamento dos funcionários cujas atribuições possuam impacto no Sistema de Gestão da Qualidade deve estar descrita.
Art. 11. Devem ser estabelecidos requisitos relacionados à saúde, higiene e vestuário do pessoal, conforme as atividades a serem realizadas.
Art. 10. A empresa deve possuir número apropriado de funcionários com qualificações adequadas garantindo que as responsabilidades atribuídas individualmente não sejam tão extensas a ponto de apresentar riscos à
qualidade do produto.
Art. 9º A estrutura organizacional da empresa deve estar descrita em organograma.
Art. 8º Os estabelecimentos que exerçam as atividades de distribuição, armazenagem ou transporte de medicamentos devem dispor de sistema de gestão da qualidade capaz de documentar, verificar e assegurar os
requisitos específicos a cada processo que possua impacto na qualidade dos produtos.
Art. 7º É permitida a aquisição de medicamentos a partir de empresas distribuidoras que não sejam as detentoras do registro desde que se garanta a rastreabilidade da carga por meio do Sistema Nacional de Controle
de Medicamentos - SNCM.
Art. 6º As empresas distribuidoras devem fornecer medicamentos somente às empresas licenciadas e autorizadas pela autoridade sanitária competente para as atividades de distribuição ou dispensação de
medicamentos.
Art. 5º Os princípios de BPA, BPDA e BPT devem ser observados também na logística reversa, quando os medicamentos estiverem sendo devolvidos ou recolhidos do mercado.
Art. 4º Todas as partes envolvidas na produção, armazenagem, distribuição e transporte devem se responsabilizar pela qualidade e segurança dos medicamentos.
Art. 2º Esta Resolução se aplica às empresas que realizam as atividades de distribuição, armazenagem ou transporte de medicamentos e, no que couber, à armazenagem e ao transporte de produtos a granel.
Art. 1º Boas Práticas de Distribuição e Armazenagem e de Boas Práticas de Transporte de Medicamentos.
Regulamentações
RESOLUÇÃO - RDC Nº 301, DE 21 DE AGOSTO DE 2019 CAPÍTULO II DO SISTEMA DA QUALIDADE FARMACÊUTICA
Art. 22. Os princípios do Gerenciamento de Riscos da Qualidade são:
I - a avaliação do risco à qualidade é baseada em conhecimento científico, experiência com o processo e, em última instância, vincula-se à proteção do paciente;
II - o nível de esforço, formalidade e documentação do processo de Gerenciamento de Risco da Qualidade é compatível com o nível de risco.
Art. 21. O Gerenciamento de Risco da Qualidade (GRQ) é um processo sistemático de avaliação, controle, comunicação e revisão de riscos para a qualidade do medicamento.
Parágrafo único. O Gerenciamento de Risco da Qualidade pode ser aplicado de forma proativa e retrospectiva.
Art. 20. Se o detentor do registro não for o fabricante do medicamento, deve existir um acordo técnico implementado entre as partes que defina as respectivas responsabilidades na elaboração da revisão de qualidade do produto.
Art. 19. Revisões de qualidade podem ser agrupadas por tipo de produto, quando justificado cientificamente.
Art. 16. As revisões da qualidade do produto devem, normalmente, ser conduzidas e documentadas anualmente, levando em consideração as revisões anteriores.
Art. 15. Revisões periódicas da qualidade de todos os medicamentos autorizados, incluindo produtos exclusivos de exportação, devem ser conduzidas com o objetivo de verificar a consistência do processo existente, a adequação das especificações aplicadas tanto para matéria-prima quanto para produto acabado, evidenciar quaisquer tendências e identificar melhorias em produtos e processos.
Art. 13. O Controle de Qualidade é a parte das BPF referente à coleta de amostras, às especificações e à execução de testes, bem como à organização, à documentação e aos procedimentos de liberação que asseguram que os testes relevantes e necessários sejam executados, e que os materiais não sejam liberados para uso, ou que produtos não sejam liberados para comercialização ou distribuição, até que a sua qualidade tenha sido considerada satisfatória.
Art. 12. Boas Práticas de Fabricação (BPF) é a parte do Gerenciamento da Qualidade que assegura que os produtos são consistentemente produzidos e controlados, de acordo com os padrões de qualidade apropriados para o uso pretendido e requerido pelo registro sanitário, autorização para uso em ensaio clínico ou especificações do produto.
Art. 11. O Sistema da Qualidade Farmacêutica deve ser definido e documentado.
Art. 10. Deve haver revisão gerencial periódica, com o envolvimento da administração superior da empresa, do desempenho do Sistema de Gestão da Qualidade Farmacêutica de forma que se identifiquem
oportunidades de melhoria contínua de produtos, processos e do próprio sistema.
Art. 9º A gestão superior da empresa tem a responsabilidade final de garantir que um Sistema da Qualidade Farmacêutica eficaz esteja implementado, disponha de recursos adequados e que as responsabilidades e
autoridades sejam definidas, comunicadas e implementadas em toda a organização.
Art. 8º Um Sistema da Qualidade Farmacêutica adequado à fabricação de medicamentos deve garantir que:
I - a concepção do produto seja alcançada por meio do projeto, planejamento, implementação, manutenção e melhoria contínua de um sistema que permita a fabricação consistente de produtos com atributos de
qualidade apropriados;
Art. 7º O tamanho e a complexidade das atividades da empresa devem ser levados em consideração ao se desenvolver um novo Sistema de Qualidade Farmacêutica ou modificar um já existente.
Art. 6º As Boas Práticas de Fabricação se aplicam a todas as etapas do ciclo de vida do produto, desde a fabricação de medicamentos experimentais, transferência de tecnologia, fabricação comercial até a descontinuação do produto.
Parágrafo único. O Sistema da Qualidade Farmacêutica pode se estender ao estágio do desenvolvimento farmacêutico, de forma a facilitar a inovação e a melhoria contínua, e fortalecer o vínculo entre o desenvolvimento farmacêutico e as
atividades de fabricação.
Art. 5º O Gerenciamento da Qualidade é um conceito abrangente, que cobre todas as questões que determinam, isolada ou conjuntamente, a qualidade de um produto.
Art. 4º O detentor de uma autorização para fabricação deve fabricar medicamentos, de forma a garantir que correspondam à finalidade pretendida, satisfaçam os requisitos do registro ou da autorização para uso em ensaio clínico, conforme
apropriado, de forma a não colocar os pacientes em risco devido à segurança, qualidade ou eficácia inadequadas.
Programa 5s
Objetivo dado pela organização, limpeza, condições de saúde, higiene, autodisciplina
5° s (shitsuke) – senso de disciplina
Funcionários são treinados continuamente (algo corriqueiro)
4° s (seiketsu) – senso de saúde e higiene
Transforma o ambiente em um local de trabalho sempre favorável à saúde e higiene
3° s(seiso) – senso de limpeza
Limpa e inspeciona o local de trabalho cuidadosamente (SEM sujeira no chão), máquinas e equipamentos
2°s (seiton) – senso de ordenação
Organiza os itens necessários de uma maneira sistemática e arrumada para qualquer pessoa possa localizar facilmente
1°s (seiri) senso de utilização
Classifica e descarta sistematicamente itens que não são necessários na organização
ISO 9000
Garantia da qualidade (certificação)
Mentalidade de risco: planejamento, implementação e mudanças do Sistema de Gestão da Qualidade.
Considerar as incertezas que tenham efeito na conformidade dos produtos e serviços
Insumo inadequado
Aspecto do produto e eficácia
Denúncia- Anvisa
Reação adversa
Reprovação do lote
Testes realizados-produtos acabados-fora da especificação-estudo
Processo solubilidade, compressão, precipitação (caso de líquidos) do insumo, e mudança do produto.
Erros na avaliação de insumo
Alteração do endereço do site de fabricação do insumo sem aviso prévio à empresa compradora
DCB diferente da cadastrada na empresa
compradora do insumo
Subtópico
Descrição do insumo não condize ao teste físico descrito no método de análise
Condições de armazenamento não claras no certificado ou na etiqueta do insumo
Certificado de análise do fabricante diferente da empresa
Entrada de insumo
Liberação do insumo para produção-testes e especificações
Entrada do insumo nos laboratórios de controle de qualidade físico-química e
microbiológico - análise conforme metodologia e especificação vigente
Conferência do laudo do fabricante e nota fiscal com a etiqueta do material recebido
Registro (Anvisa)
IFA sendo importado por uma importadora, e se outra também importar deve registrá-lo.
Petição do Registro de medicamento e IFA (importado ou nacional)
Sem vinculação com o registro de medicamento
Insumo farmacêutico ativo (IFA)
Farmoquímicos
Seguro e eficaz