af Jiménez Pérez Ana Patricia 3 år siden
201
JiménezPérezAnaPatricia. 5B. LQ
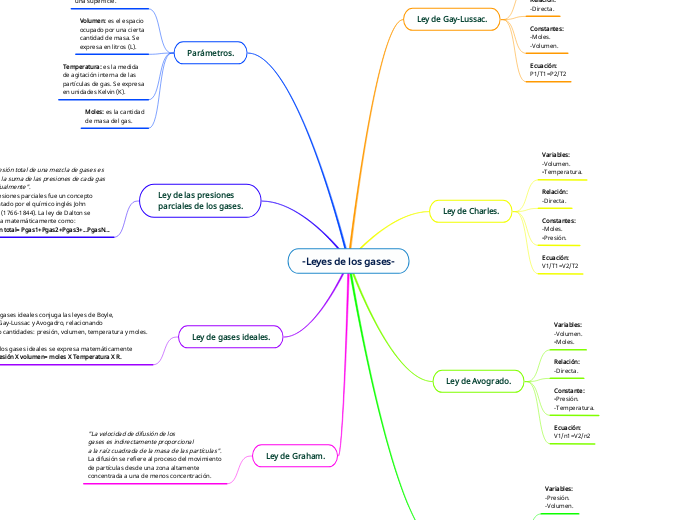
Las leyes de los gases son fundamentales para entender el comportamiento de los gases en diversas condiciones. La ley de gases ideales unifica las leyes de Boyle, Charles, Gay-Lussac y Avogadro, relacionando presión, volumen, temperatura y moles en una sola ecuación.