af Alexandra Pitombeira 5 år siden
1092
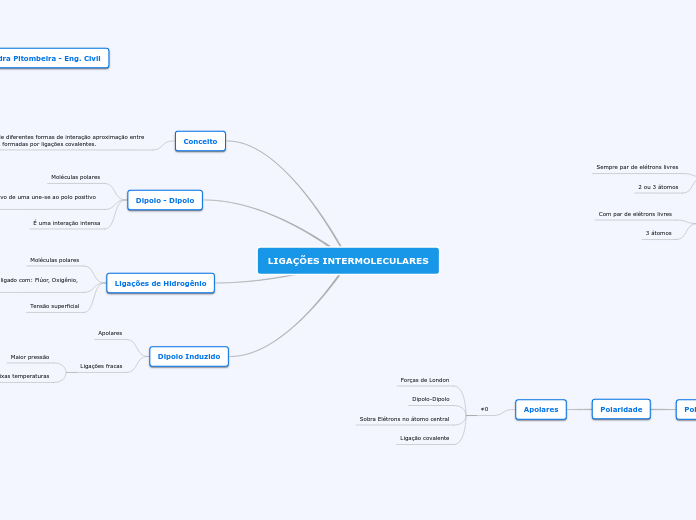
LIGAÇÕES INTERMOLECULARES
O texto aborda as diferentes formas de interações intermoleculares e a geometria molecular, além de discutir a polaridade das moléculas. Ligações intermoleculares incluem forças de London, dipolo-dipolo e ligações de hidrogênio, que ocorrem entre átomos de hidrogênio ligados a flúor, oxigênio ou nitrogênio.