modelos de enlace
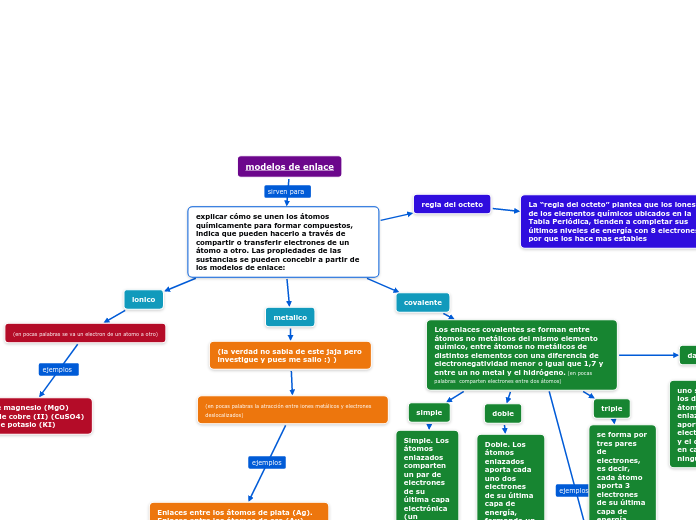
explicar cómo se unen los átomos químicamente para formar compuestos, indica que pueden hacerlo a través de compartir o transferir electrones de un átomo a otro. Las propiedades de las sustancias se pueden concebir a partir de los modelos de enlace:
regla del octeto
La “regla del octeto” plantea que los iones de los elementos químicos ubicados en la Tabla Periódica, tienden a completar sus últimos niveles de energía con 8 electrones por que los hace mas estables
metalico
(la verdad no sabia de este jaja pero investigue y pues me salio :) )
(en pocas palabras la atracción entre iones metálicos y electrones deslocalizados)
Enlaces entre los átomos de plata (Ag).
Enlaces entre los átomos de oro (Au).
Enlaces entre los átomos de cadmio (Cd).
covalente
Los enlaces covalentes se forman entre átomos no metálicos del mismo elemento químico, entre átomos no metálicos de distintos elementos con una diferencia de electronegatividad menor o igual que 1,7 y entre un no metal y el hidrógeno. (en pocas palabras comparten electrones entre dos átomos)
=Oxígeno puro (O2). O=O (un enlace doble)
=Hidrógeno puro (H2). H-H (un enlace simple)
=Dióxido de carbono (CO2). O=C=O (dos enlaces dobles)
=Agua (H2O). H-O-H (dos enlaces simples)
=Ácido clorhídrico (HCl). H-Cl (un enlace simple)
=Nitrógeno puro (N2). N≡N (un enlace triple)
=Ácido cianhídrico (HCN). H-C≡N (un enlace simple y uno triple)
dativo
uno solo de los dos átomos enlazados aporta dos electrones y el otro, en cambio, ninguno
triple
se forma por tres pares de electrones, es decir, cada átomo aporta 3 electrones de su última capa de energía.
doble
Doble. Los átomos enlazados aporta cada uno dos electrones de su última capa de energía, formando un enlace de dos pares de electrones.
simple
Simple. Los átomos enlazados comparten un par de electrones de su última capa electrónica (un electrón cada uno).
ionico
(en pocas palabras se va un electron de un atomo a otro)
Óxido de magnesio (MgO)
Sulfato de cobre (II) (CuSO4)
Ioduro de potasio (KI)