объясните - почему?
Студентам необходимо подумать над вопросом: почему работа с растительными клетками имеет меньше этических проблем, чем работа с клетками человека или высших животных?
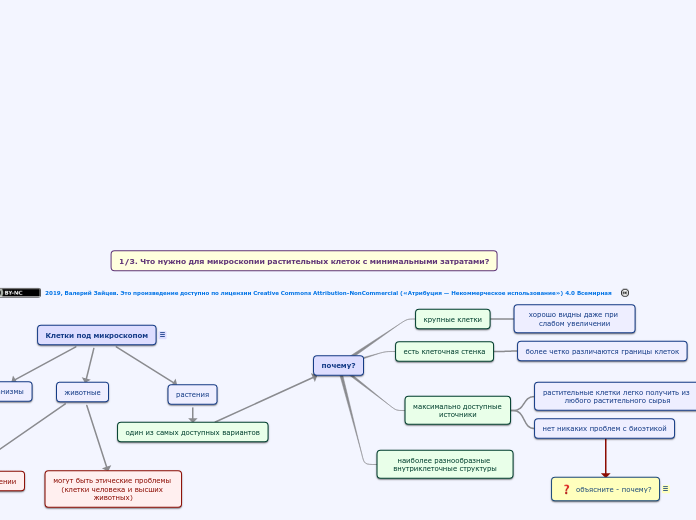
почему?
наиболее разнообразные внутриклеточные структуры
максимально доступные источники
нет никаких проблем с биоэтикой
растительные клетки легко получить из любого растительного сырья
есть клеточная стенка
более четко различаются границы клеток
крупные клетки
хорошо видны даже при слабом увеличении
Использованные публикации
Suslov e.a., 2009
Suslov D., Verbelen J.-P., Vissenberg K. Onion epidermis as a new model to study the control of growth anisotropy in higher plants. J. Exp. Botany. 2009; 60(14): 4175-4187. doi: 10.1093/jxb/erp251
Лабораторная работа 1/3
оформление результатов
Выполняется внеаудиторно. Загружается дистанционно для оценки преподавателем с использованием выбранного формата интерактивного общения (LMS, облачное файлохранилище, социальные сети, онлайн-сервисы организации совместной работы и т.д.).
сравнительный анализ результатов группы с их обсуждением и выводом
1/3 в - описательное
1/3 б - описательное
В свободной форме, обязательно отражающей:
- цель эксперимента,
- проверяемую научную гипотезу (формулируется самим студентом),
- протокол экспериментов с различными условиями проведения,
- результаты экспериментов,
- сравнительный анализ результатов микроскопии различных типов эпидермиса с обязательной оценкой морфологических особенностей и клеточного состава,
- сравнительный анализ результатов микроскопии неокрашенных и окрашенных препаратов,
- обсуждение результатов воздействия абиогенных стрессоров
- общий вывод с указанием, была ли подтверждена научная гипотеза.
Эссе рекомендуется сопровождать изображениями и / или видеофайлами, полученными в ходе экспериментов.
1/3 а - описательное
В свободной форме, отражающей:
- цель эксперимента,
- протокол выполнения работы,
- пошаговые иллюстрации выполнения протокола в виде фото- или видеофайлов:
- общий вывод.
лабораторные протоколы
1/3 в. Флуоресцентная микроскопия эпидермиса растений
Протокол выполнения опыта
Красители: акридиновый оранжевый, тетрациклина гидрохлорид, нейтральный красный.
Исследуемые клетки: клетки эпидермиса лука; клетки эпидермиса листьев. Работа выполнятся в паре, один из студентов работает с эпидермисом луковицы, другой - с эпидермисом зеленого листа.
Микроскопия собственной флюоресценции клеток
- подготовьте предметное стекло для работы, обезжирив его изопропанолом;
- отрежьте от образца эпидермиса небольшой участок (по размеру меньше, чем покровное стекло);
- перенесите кусочек эпидермиса на предметное стекло, аккуратно расправьте его, чтобы он не сминался (это важно для получения монослоя клеток);
- нанесите на эпидермис немного воды, чтобы слегка смочить его по всей площади;
- положите на препарат эпидермиса покровное стекло и аккуратно прижмите его для фиксации (если необходимо, уберите выступивший излишек воды фильтровальной бумагой);
- изучите получившийся препарат путем микроскопирования с помощью люминесцентного микроскопа (лабораторного и/или сопрягаемого со смартфоном) при различных длинах волн возбуждения.
Флуоресцентная микроскопия окрашенных препаратов
- выполните предыдущий протокол, но с предварительным окрашиванием эпидермиса растворами акридинового оранжевого, нейтрального красного или тетрациклина (различные концентрации, выдаются преподавателем);
- приготовьте 4 кусочка эпидермиса;
- перед переносом на предметное стекло поместите кусочки эпидермиса в растворы изучаемого красителя на 2, 5 и 10 минут;
- после окрашивания удалите краситель и быстро промойте эпидермис дистиллированной водой;
- перенесите эпидермис на предметные стекла и изучите получившийся препарат путем микроскопирования с помощью люминесцентного микроскопа (лабораторного и/или сопрягаемого со смартфоном) при различных длинах волн возбуждения.
Изучение различных абиогенных стрессоров на препараты эпидермиса растений
- проведите микроскопическое изучение окрашенных и неокрашенных препаратов после воздействия нескольких различных абиогенных стрессоров (окрашивание акридиновым оранжевым или тетрациклином, выберите оптимальное время окрашивания из предыдущего эксперимента);
- виды абиогенных стрессоров (растворы различных концентраций солей или разбавленных кислот или щелочей, других химических соединений, воздействие ультрафиолетового излучения или видимого света и т.п.) выбираются группой в ходе совместного обучения во время вводного мини-коллоквиума занятия.
1/3 б. Световая микроскопия эпидермиса растений
Протокол выполнения опыта
Красители: используется раствор красителя, приготовленный данной парой студентов в ходе лабораторной работы 1/2.
Исследуемые клетки: клетки эпидермиса лука; клетки эпидермиса листьев. Работа выполнятся в паре, один из студентов работает с эпидермисом луковицы, другой - с эпидермисом зеленого листа.
Световая микроскопия неокрашенных препаратов
- подготовьте предметное стекло для работы, обезжирив его изопропанолом;
- отрежьте от образца эпидермиса небольшой участок (по размеру меньше, чем покровное стекло);
- перенесите кусочек эпидермиса на предметное стекло, аккуратно расправьте его, чтобы он не сминался (это важно для получения монослоя клеток);
- нанесите на эпидермис немного воды, чтобы слегка смочить его по всей площади;
- положите на препарат эпидермиса покровное стекло и аккуратно прижмите его для фиксации (если необходимо, уберите выступивший излишек воды фильтровальной бумагой);
- изучите получившийся препарат путем микроскопирования с помощью лабораторного настольного микроскопа (с установленным видеоокуляром или со встроенной камерой) и микроскопа, монтирующегося на смартфон, и/или недорого компактного настольного цифрового микроскопа;
- сделайте фотографии, которые позволят сравнить степень увеличения, резкость и разрешающую способность разных микроскопов.
Световая микроскопия окрашенных препаратов
- выполните предыдущий протокол, но с предварительным окрашиванием эпидермиса красителем из работы 1/2;
- приготовьте 4 кусочка эпидермиса;
- перед переносом на предметное стекло поместите кусочки эпидермиса в растворы изучаемого красителя с концентрацией 0,25%, 0,1%, 0,05% и 0,01% на 10 минут;
- после окрашивания удалите краситель и промойте эпидермис двумя-тремя порциями дистиллированной воды;
- перенесите эпидермис на предметные стекла и проведите микроскопирование с помощью различных микроскопов;
- сделайте фотографии, которые позволят сравнить степень увеличения, резкость и разрешающую способность разных микроскопов.
Изучение различных абиогенных стрессоров на препараты эпидермиса растений
- проведите микроскопическое изучение окрашенных и неокрашенных препаратов после воздействия нескольких различных абиогенных стрессоров;
- виды абиогенных стрессоров (растворы различных концентраций солей или разбавленных кислот или щелочей, других химических соединений, воздействие ультрафиолетового излучения или видимого света и т.п.) выбираются группой в ходе совместного обучения во время вводного мини-коллоквиума занятия.
1/3 а. Получение монослоев растительных клеток без срезов
Протокол выполнения опыта
Образцы: луковица репчатого лука; зеленые листья растений (желательно с легко отделяемым эпидермисом нижней стороны листа).
Получение клеточных образцов эпидермиса луковицы
- очистите небольшой участок поверхности луковицы от внешних сухих слоев (сухих чешуй);
- аккуратно снимите участок внешней (или одной из подлежащих) сочной чешуи, стараясь не повредить тонкую пленку межчешуйного эпидермиса;
- снимите с луковицы участок межчешуйного эпидермиса и перенесите его в плоский сосуд с водой;
- расправьте пленку эпидермиса в воде, так чтобы она была полностью смочена и не сворачивалась и не сминалась;
- до проведения экспериментов держите эпидермис в смоченном состоянии (в течение не более 2 часов).
Получение клеточных образцов эпидермиса зеленых листьев
- возьмите зеленый лист растения с легко снимаемым эпидермисом нижней стороны листа (хорошим вариантом являются листья традесканции, ивы или истинные листья молодых проростков бобовых растений, например, гороха или фасоли);
- аккуратно подцепите пленку эпидермиса на нижней стороне листа (возможно придется сделать небольшой неглубокий надрез по поверхности) и снимите её - по возможности - полностью;
- снимите с луковицы участок межчешуйного эпидермиса и перенесите его в плоский сосуд с водой;
- расправьте пленку эпидермиса в воде, так чтобы она была полностью смочена и не сворачивалась и не сминалась;
- до проведения экспериментов держите эпидермис в смоченном состоянии (в течение не более 2 часов).
организация работы
Подготовительная часть (преподаватель + лаборант): подготовка необходимых материалов и оборудования.
Подготовительная часть (студенты): растворы красителей, приготовленные для лабораторных работ по исследовательскому вопросу 1/2.
Основная часть (студенты на занятии): работа 1/3 а выполняется по потребности получения образцов для последующих работ. Работа 1/3 б выполняется в тех же парах, что и работа по исследовательскому вопросу 1/2 (с теми же красителями). Воздействие абиогенных стрессоров проводится одновременно для образцов всех студентов в группе. Работа 1/3 в выполняется индивидуально.
Важно! Поскольку студенты работают с разными условиями экспериментов преподавателю следует обеспечить студентам возможность ознакомиться с результатами друг друга. Делать это в ходе выполнения эксперимента или во время заключительного мини-коллоквиума занятия - выбор преподавателя.
результаты обучения
вопросы для обсуждения
- Почему флюоресцентное окрашивание структур клетки часто показывает их как более крупные по размеру, чем окрашивание нефлюоресцентными красителями?
- Почему работа с растительными клетками имеет меньше этических проблем, чем работа с клетками человека или высших животных?
- Чем - с точки зрения клеточного строения - отличаются эпидермис луковицы репчатого лука и эпидермис нижней стороны зеленого листа? С чем связано это различие?
- Чем объяснить различия в наличии или отсутствии определенных видимых признаков под действием абиотических стрессоров при окрашивании препаратов различными красителями?
- В чем причина отличий в собственной флуоресценции клеток эпидермиса луковицы и зеленых листьев?
развиваемые навыки
- формулировать научную гипотезу для последующей экспериментальной проверки
- подготавливать образцы для последующей микроскопии
- выбирать условия для общей или компонент-специфичной окраски растительных клеток
- искать замену (альтернативу) лабораторных реактивов (включая красители) среди общедоступных материалов и химикатов
Клетки под микроскопом
Одна из наиболее широко применяемых в отечественных исследованиях сред для выращивания инфузорий рода Paramecium - среда Лозино-Лозинского.
Обычно она готовится в виде концентрата 10-кратной концентрации (10x). Концентрат среды Лозина-Лозинского готовится следующим образом: в 1 литре дистиллированной воды растворяют 0,1 г NaCl, 0,01 г KCl, 0,2 г NaHCO3, 0,01 г MgSO4 х 7 H2O, 0,01 г CaCl2. Для приготовления рабочего раствора (инкубационной смеси) смешивают 1 объем концентрата с 9 объемами воды (например, 100 мл концентрата + 900 мл воды).
Культура парамеций лучше всего выращивать при температуре 20-25˚C с естественной рассеянной освещенностью в течении дня или с искусственным чередованием света и темноты («день-ночь») 12 + 12 часов в течение суток.
В качестве корма можно использовать множество веществ и продуктов, но одним из самых простых, доступных и легко стандартизируемых вариантов являются обычные сухие пекарские дрожжи. Активные (быстрорастворимые) дрожжи лучше, чем те, которые требуют предварительной инкубации в жидкости. Рекомендуемый режим кормления 0,07 г сухих дрожжей на культуру объемом 400-600 мл 2 раза в неделю. Перед добавлением в культуру дрожжи суспендируются в 10 мл воды для более равномерного распределения в культуре.
Через каждые 1-2 недели культуру инфузорий требуется отмывать от остатков корма и продуктов метаболизма. Для этого культуру инфузорий переливают в узкогорлую колбу, которую накрывают темной тканью, оставляя открытым горлышко. Средой Лозино-Лозинского доводят до верха. Через некоторое время инфузории выплывают в верхнюю часть колбы, после чего их отбирают дозатором на 10 мл и переносят в чистый стакан, а затем снова доливают средой Лозино-Лозинского. Процедура повторяется до тех пор, пока культура не станет прозрачной. После отмывки инфузории необходимо покормить, а на сосуд с ними поставить дату последней отмывки.
растения
один из самых доступных вариантов
животные
могут быть этические проблемы (клетки человека и высших животных)
часто более сложные в получении
микроорганизмы
недостаточно крупные
Могут быть плохо различимы при слабом увеличении, которое доступно для микроскопов, монтирующихся на смартфоны, и для многих «домашних» микроскопов
2019, Валерий Зайцев. Это произведение доступно по лицензии Creative Commons Attribution-NonCommercial («Атрибуция — Некоммерческое использование») 4.0 Всемирная
1/3. Что нужно для микроскопии растительных клеток с минимальными затратами?