von Ros Huertas Lucia Vor 4 Jahren
372
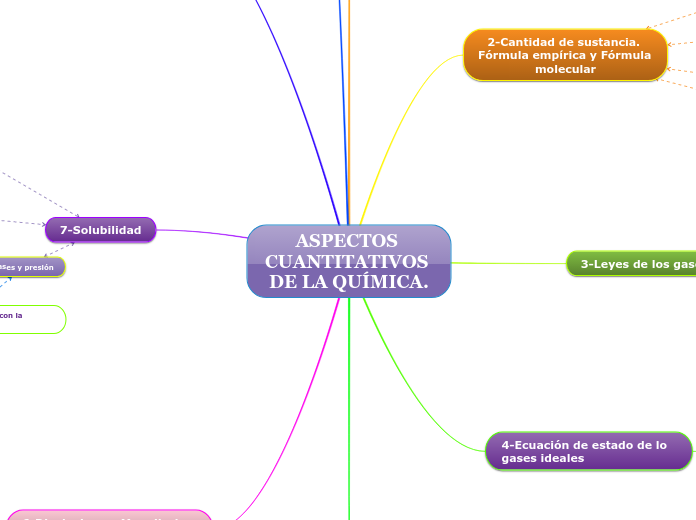
ASPECTOS CUANTITATIVOS DE LA QUÍMICA.
El texto aborda diversos conceptos y leyes fundamentales de la química, centrándose en la termodinámica, la solubilidad y las propiedades coligativas de las sustancias. Se explica cómo la presión y la temperatura afectan la solubilidad de gases y sólidos, así como la importancia de las disoluciones y las magnitudes asociadas, como la molaridad, la molalidad y la fracción molar.