Alexandra Pitombeira - Eng. Civil
Ânion -
Cation +
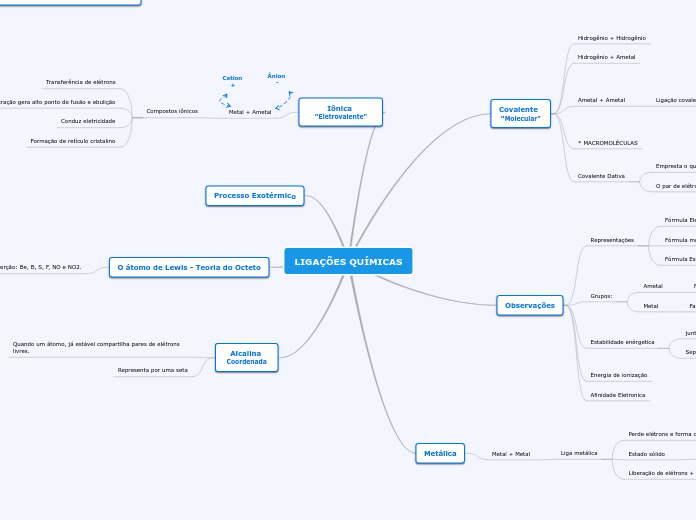
LIGAÇÕES QUÍMICAS
Alcalina Coordenada
Representa por uma seta
Quando um átomo, já estável compartilha pares de elétrons livres.
O átomo de Lewis - Teoria do Octeto
Exerção: Be, B, S, F, NO e NO2.
Processo Exotérmico
Iônica "Eletrovalente"
Metal + Ametal
Compostos iônicos
Formação de retículo cristalino
Conduz eletricidade
A alta atração gera alto ponto de fusão e ebulição
Transferência de elétrons
Metálica
Metal + Metal
Liga metálica
Liberação de elétrons + externos
"mar de elétrons"
Estado sólido
Retículos cristalinos
Perde elétrons e forma cátions
Baixa Eletronegatividade
Observações
Afinidade Eletronica
Energia de ionização
Estabilidade enérgetica
Separados (Energia Maior)
juntos (energia menor)
Grupos:
Metal
Família: 1A ; 2A ; 3A
Ametal
Família: 5A ; 6A ; 7A
Representações
Fórmula Estrutural Plana
Fórmula molecular
Fórmula Eletrônica
Covalente "Molecular"
Covalente Dativa
O par de elétron é de único ATM
Empresta o que não usa
* MACROMOLÉCULAS
Ametal + Ametal
Ligação covalente
Substâncias puras (não conduz eletricidade)
Baixos Ponto de fusão e ebulição
Compartilhamento de elétron
Hidrogênio + Ametal
Hidrogênio + Hidrogênio