von Lilia Edith Rivera Vor 4 Jahren
486
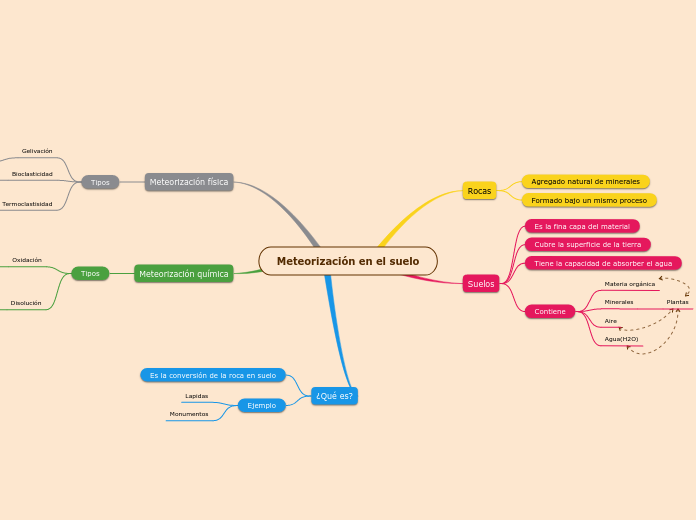
Organigrama
Las propiedades químicas son características intrínsecas de las sustancias que permiten su transformación mediante reacciones químicas, alterando su composición original. Entre estas propiedades se encuentra la hidrólisis, un proceso en el cual las moléculas de agua se dividen en hidrógeno y oxígeno, formando nuevos enlaces con otras sustancias.