von laura c Vor 1 Jahr
327
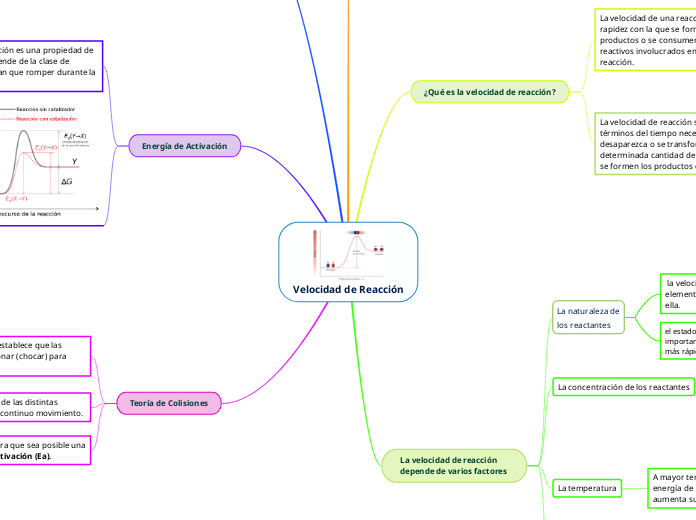
Velocidad de Reacción
La cinética química estudia los mecanismos y factores que influyen en la velocidad de las reacciones químicas. La teoría de colisiones sugiere que las moléculas deben chocar para reaccionar, y el número de colisiones por unidad de tiempo afecta directamente la probabilidad de que ocurra una reacción.