von Jana Prekratić Vor 6 Jahren
217
znanje iz 1. polugodišta
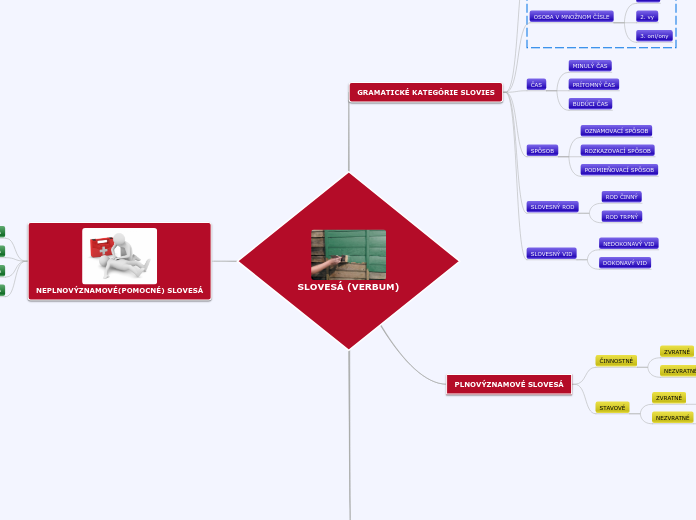
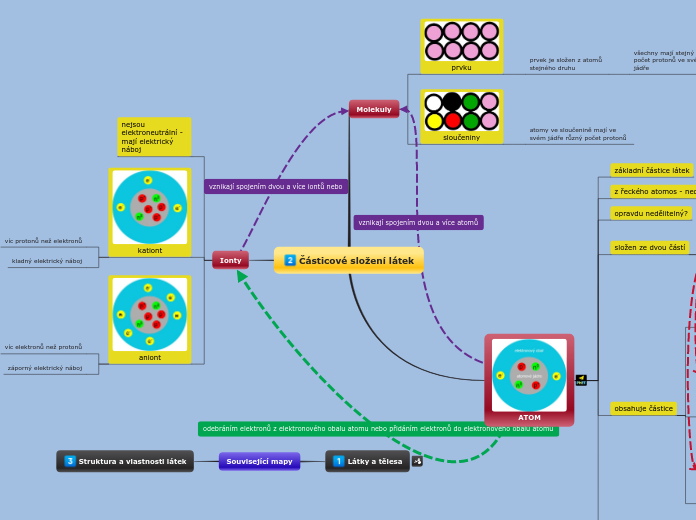
Atomy jsou základní stavební jednotky hmoty, skládající se z jádra obsahujícího protony a neutrony a elektronového obalu. Izotopy jsou varianty jednoho chemického prvku, které mají stejný počet protonů, ale různý počet neutronů.