znanje iz 1. polugodišta
IZOBARI
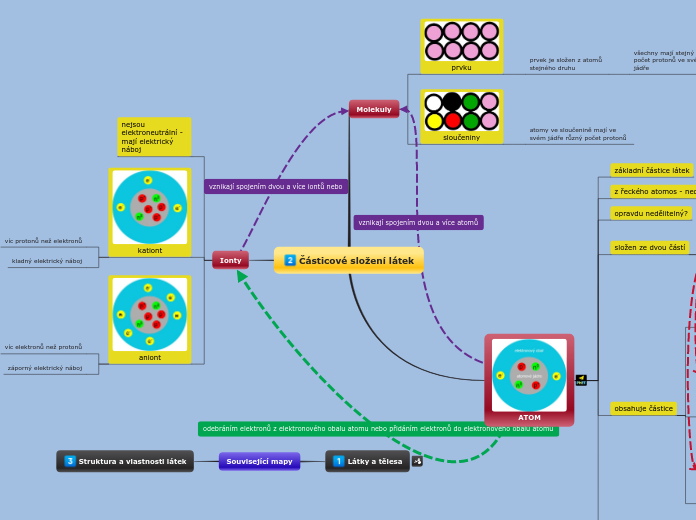
atomi s istim masenim, a različitim atomskih brojem
IONIZACIJA
energija ionizacije je energija potrebna da se neutralnom atomu ili ionu u plinovitom stanju izbije elektron
raste uzduž perioda i pada uzduž skupina
nastajanje električki nabijenih čestica, iona, iz neutralnih atoma ili molekula
UNIFICIRANA ATOMSKA JEDINICA MASE
relativna masa kemijskog elementa se izračunava tako
da masu atoma kemijskog elementa podijelimo s unificiranom atomskom jedinicom mase iz čega proizlazi formula
Ar(X)=ma/u
to je jedna dvanaestina izotopa ugljika nukleonskog
-27
broja 12 i iznosi 1,6605x10 kg
jedinica prema kojoj se određuju relativne atomske
mase elemenata
AFINITET PREMA ELEKTRONU
unutar periode raste porastom protonskog broja, a unutar skupine pada
energja koja se oslobodi kada neutralni atom u plinovitom stanju primi elektron
ATOM
sastoji se od jezgre u kojoj se nalaze protoni i neutroni te elektronskog omotača u kojem se nalaze protoni
stabilna i neutralna čestica koja se sastoji od jezgre i odgovarajućeg broja elektrona
IZOTOPI
atomi istog protonskog, a različitog nukleonskog broja
TVAR
materija/supstanca
bilo koji stupanj organizacije
SUBATOMSKA ČESTICA
elektroni, protoni, neutroni
NUKLEONSKI BROJ
označava broj subatomskih čestica u jezgri,
odnosno broj protona i neutrona
PROTONSKI BROJ
u PSE piše iznad simbola elementai raste s lijeva na desno
označava broj protona nekog elementa