Enlace químico
de formación y ruptura de los mismos
Reacción química
se puede clasificar según
Cambio estructural
Condensación
2 moléculas para liberar agua
formación de ester a través de unir un acido y alcohol
Adición
Átomos o grupos que no estaban inicialmente
Polimerización
Muchas moléculas iguales para aumentar la cadena
Eliminación
Se elimina un átomo o grupos de átomos a una molécula
Sustitución
sustituir un átomo o grupo de átomos por otro
mecanismos de reacción
rompimiento de enlaces
Heterolítica
uno de los grupos en que se divide la molécula se lleva los
dos electrones
Este tipo de ruptura da lugar a
carbaniones
carbocationes
Homolíticas
cada átomo se separa
conservando un electrón
Las especies resultantes tienen un
electrón desapareado
carecen de
carga y se denominan "radical libre"
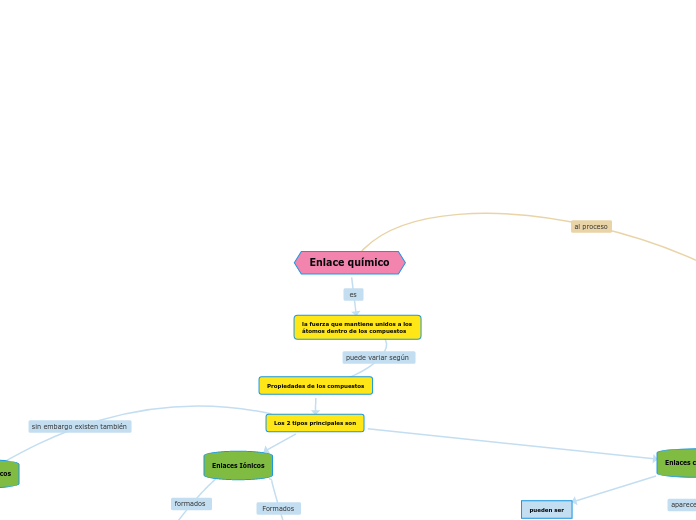
la fuerza que mantiene unidos a los átomos dentro de los compuestos
Propiedades de los compuestos
Los 2 tipos principales son
Enlaces metálicos
metales
Modelos
De Bandas
explica
Alejamiento de las bandas y como genera características aislantes
conductividad en solidos metálicos,(paso de una banda a otra)
Teoría del orbital molecular
apareacion de electrones en orbitales con energía de enlaces y anti enlaces
multiplicación de orbitales
Bandas de valencia
Orbitales con electrones apareados
Bandas de conducción
Orbitales vacíos
Nube electrónica
Los electrones que forman enlace
deslocalizados
libremente
metales poseen orbitales vacíos
Poseen características como
Buenos conductores eléctricos
Brillo metálico
Elevada densidad
Enlaces covalentes
pueden ser
NO POLARES
la densidad electrónica es simétrica
los electrones son compartidos
igualmente por los dos núcleos de las moléculas
POLARES
la densidad
electrónica en la molécula sera mayor
existe un momento dipolar
Puede ser
TRIPLE cuando comparten tres
pares electrónicos (ejemplo molécula de nitrógeno, N2)
DOBLE cuando comparten dos
pares electrónicos (ejemplo molécula de oxígeno, O2)
SENCILLO cuando comparten un par
de electrones (ejemplo molécula de hidrógeno; H2)
al compartir
uno o más pares de electrones
entre dos átomos
trataran de completar 8 e- en su capa más externa
una configuración mas estable
a un gas noble
Enlaces Iónicos
con mayor
facilidad cuando reaccionan elementos con
elevadas electronegatividades y afinidad electrónica (no metales)
ganan fácilmente electrones
energía de ionización pequeña (metales)
pierden fácilmente electrones
por transferencia de uno o más electrones
de un átomo o grupo de átomos a otro