por itzel bracamontes hace 4 años
774
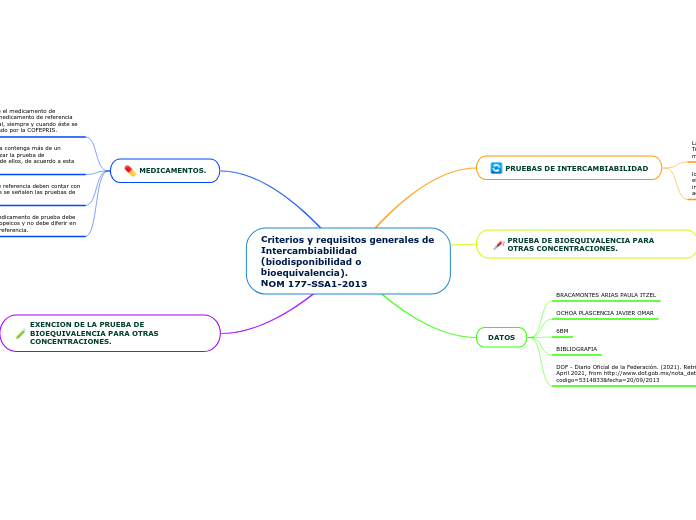
NOM 177-SSA1-2013
La normativa establece criterios y requisitos esenciales para la intercambiabilidad de medicamentos, incluyendo aspectos de biodisponibilidad y bioequivalencia. Se permite una variación en la forma de dosificación hasta un 10%