Seguimiento a embarazadas VIH positivas
La asistencia y tratamiento de las gestantes infectadas por VIH es una tarea primordial del profesional de la salud, para lo cual necesita ayuda de un equipo multidisciplinario
Se recomienda realizar las siguientes acciones para el seguimiento de las mujeres embarazadas
Recomendar vigilancia de alteraciones asociadas al uso de TARV
Valorar cuidadosamente procedimientos invasivos
En mujeres con CD4+ menor de 200, iniciar profilaxis de infecciones oportunistas
Determinar carga viral entre las 34-36 semanas para establecer fecha de parto o cesárea
Determinar carga viral a las 2-4 semanas de iniciar tratamiento.
Solicitar recuento de CD4+ en el control inicial con frecuencia trimestral.
Continuar los controles prenatales
Continuar la TARV
Tratamiento
Esquemas de preferencia
ITIAN con alto paso transplacentario y un INI (raltegravir) o un IP/r
Regímenes Iniciales de Embarazadas sin TARV
ALTERNATIVAS
Tenofivir 300mg/Lamivudina 150 mg, VO, una vez al día + Darunavir 600mg/ritonavir 100 mg, VO, 2 veces al día
Tenofivir 300mg/Emtricitabina 200 mg, VO, una vez al día + Darunavir 600mg/ritonavir 100 mg, VO, 2 veces al día
PREFERENTES
Tenofivir 300mg/Lamivudina 150 mg, VO, una vez al día + raltegravir 400 mg, VO, 2 veces al día
Tenofivir 300mg/ emtricitabina 200 mg, VO, una vez al día + raltegravir 400 mg, VO, 2 veces al día
Recomendaciones sobre los esquemas
Seleccionar fármacos en esquemas eficaces, seguros y de fácil cumplimiento
Realizar estudio de resistencia antes de iniciar el tratamiento o en fracaso virológico
Informar el riesgo de parto prematuro
Considerar que la farmacocinética de los ARV puede afectarse por la fisiología del embarazo.
Su objetivo es reducir o mantener la CV indetectable y reducir la transmisión materno-infantil
Carga viral indetectable
La falta de control temprano y adherencia
Momento de inicio de TARV
La TARV está indicada en todas las embarazadas, independientemente del número de CD4+ y de su carga viral
Los beneficios de la TARV en el embarazo son:
Protege la salud de la gestante
Disminuye el reisgo de transmisión materno infantil
Reduce la concentración del virus
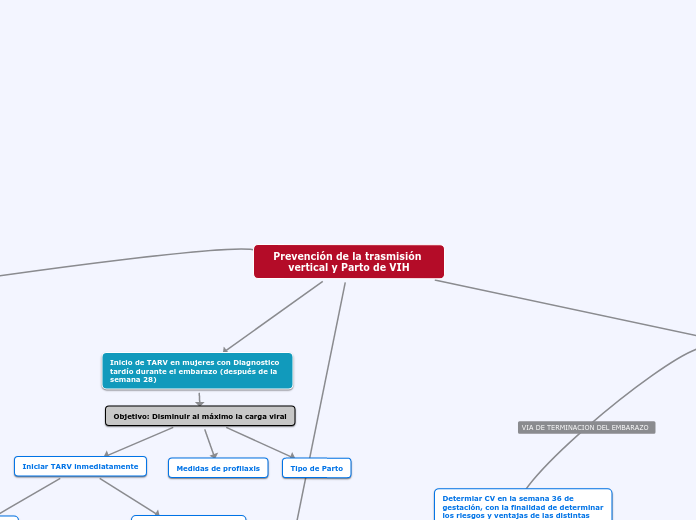
Prevención de la trasmisión vertical y Parto de VIH
Seguimiento de embarazo en mujeres VIH que se encuentran recibiendo terapia antirretroviral
En caso de cambiar el TARV
Monitorizar la carga viral frecuentemente
Mantener el mismo esquema
Esquema con EFV
Estudios acerca de los defectos que provocan en el tubo neural se realizaron en primates, así que su seguridad todavia no es comprobada
Condiciones
Haya supresión viral, buena tolerancia, los medicamentos sean recomendados en el embarazo
PARTO
Profilaxis ARV con AZT por vía IV AZT: 2 mg/kg de peso durante 1 h, luego 1 mg/kg de peso/hora hasta finalizar el parto.* Independientemente del esquema de la TARV usado previamente.
COMPLICACIONES
RUPTURA PREMATURA DE MEMBRANAS
Realizar el manejo de la RPM en la mujer seropositiva siguiendo las pautas de
tratamiento de la gestante sin VIH, excepto en casos de carga viral elevada donde
puede ser necesario finalizar la gestación precozmente.
HEMORRAGIA
Practicar cesárea si no cesa la hemorragia.
Realizar manejo expectante hasta las 37-38 semanas, de lograrse controlar la
hemorragia.
AMENAZA DE PARTO PREMATURO
Administrar junto al tratamiento tocolítico, AZT I.V 2 mg/kg dosis inicial en infusión
para una hora, seguida de 1mg/kg/hora hasta por 24 horas debido a la toxicidad del
AZT.
Considerar la terminación del embarazo ante el fallo de tocólisis, ya sea por parto
vaginal o por cesárea de acuerdo a evaluación de cada caso.
Considerar que las mujeres que reciben TARV deben continuar con el tratamiento,
y las que no, deben iniciarla
Iniciar AZT IV + TDF/FTC + RAL** en mujeres que no hayan recibido TARV durante el embarazo o que hayan iniciado posterior a la semana 28 de gestación.
Asegurar la administración de la pauta habitual de TARV oral durante el parto o
cesárea.
Administrar AZT IV 2 a 3 horas antes del parto por cesárea y continuar infusión
hasta el corte del cordón umbilical.
Determiar CV en la semana 36 de gestación, con la finalidad de determinar los riesgos y ventajas de las distintas modalidades.
Parto vaginal o cesárea en mujeres con CV entre 50 y 1000 copias, se debe individualizar tomando a consideración que en presencia de : CV>400 copias/mL, la conducta a seguir deberá basarse en los antecedentes de adherencia a la TARV y la presencia o no de fracasos previos.
CESÁREA
Ruptura prematura de membranas (RPM) o en presencia de otra contraindicación obstétrica para parto céfalovaginal
Realizar cesárea a las gestantes que inicien el control prenatal y la TARV en el
último trimestre del embarazo o cerca de parto (posterior a la semana 28)
Programar parto por cesárea para la semana 38 de gestación
Realizar de manera obligatoria cesárea a gestantes con TARV y CV desconocida
o > 1 000 copias/ml.
PARTO VAGINAL
Administrar 1 mg de cabergolina en dosis única vía oral a toda mujer durante el
primer día postparto para supresión de secreción láctea, a menos que exista una
contraindicación obstétrica.
Evitar procedimientos invasivos para monitorizar el bienestar fetal.
Evitar la ruptura artificial de membranas a menos que las condiciones del parto lo
requieran
inicio de labor de parto antes de la fecha
en que estaba prevista la cesárea, si la progresión del parto es rápida y la CV
materna es indetectable
Inicio de TARV en mujeres con Diagnostico tardío durante el embarazo (después de la semana 28)
Objetivo: Disminuir al máximo la carga viral
Tipo de Parto
Medidas de profilaxis
Iniciar TARV inmediatamente
Esquema que contenga Raltegravir debido a que suprime rapidamente la carga viral
En 2 semanas disminuye aproximadamente 2 log copias/ml
Si se desconoce la carga viral o es mayor a 100 000 copias/ ml,
Al esquema de TARV agregar como cuarto medicamento raltegravir