Donde K es la constante de equilibrio
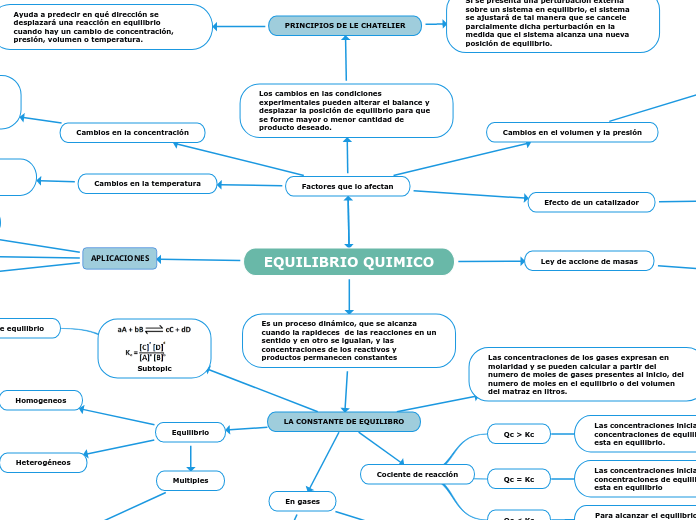
Equilibrio
Homogeneos
Se aplica
A las reacciones en las que todas las especies reactivas se encuentran en la misma fase.
Heterogéneos
En una reacción reversible en la que intervienen reactivos y productos en distintas fases.
Multiples
Si una reacción se puede expresar como la suma de dos o más reacciones, la constante de equilibrio para la reacción global estará dada por el producto de las constantes de equilibrio de las reacciones individuales.
Reacción Global
Por tanto
En gases
Las concentraciones de reactivos y productos en las reacciones de gases también se pueden expresar en términos de sus presiones parciales.y productos en las reacciones de gases también se pueden presen
Donde "Px" es igual a las presiones parciales de cada reactivo o producto según su equivalente.
Para gases ideales
PxV=nxRT
Donde "x" es la variable dependiente de cada reactivo o producto.
Cociente de reacción
Qc < Kc
Para alcanzar el equilibrio, los reactivos deben convertirse en productos
Qc = Kc
Las concentraciones iniciales son las concentraciones de equilibrio. El sistema esta en equilibrio
Qc > Kc
Las concentraciones iniciales son las concentraciones de equilibrio. El sistema esta en equilibrio.
Las concentraciones de los gases expresan en molaridad y se pueden calcular a partir del numero de moles de gases presentes al inicio, del numero de moles en el equilibrio o del volumen del matraz en litros.
EQUILIBRIO QUIMICO
APLICACIONES
Reduce la temperatura para sus procesos metabólicos en el organismo con la ayuda de los farmacos.
En la industria cervecera para determinar el tiempo y velocidad de la fermentación de la cebada
Maquinas vaporizantes y bombas centrifugas.
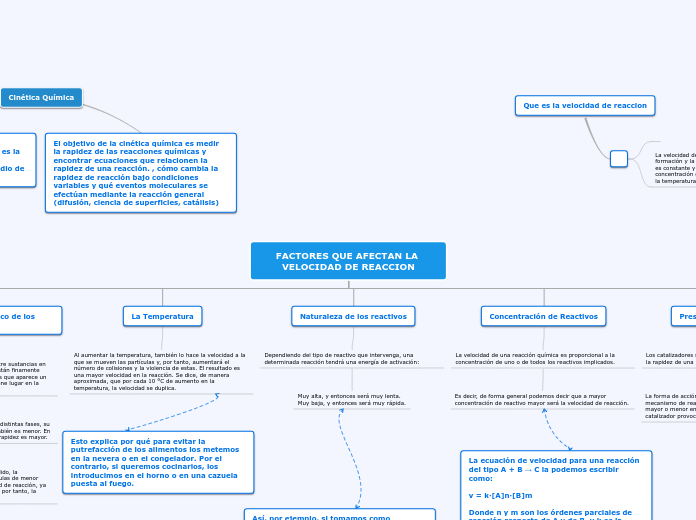
Factores que lo afectan
Cambios en la temperatura
Una elevación en la temperatura agrega calor al sistemaq y una caida en la temperatura remueve calor del sistema
Un amento en la temperatura favorece una reacción endotérmica y una disminución de temperatura favorece una reacción exotérmica
Cambios en la concentración
En este caso podemos ver como las disoluciones cambian de color debido a la reacción que tienen los reactivos y productos según estos aumentan o disminuyen.
Al aumentar las concentraciones de los productos el equilibrio se desplaza hacia la izquierda y al disminuir la concentración el equilibrio se desplaza hacía la derecha.
Subtopic
Efecto de un catalizador
Aumenta la rapidez de una reacción al reducir la energía de activación de la reacción y disminuye la energía de activación de la reacción hacia la derecha y de la reacción hacia la izquierda en la misma magnitud.
Cambios en el volumen y la presión
P= (n/V)RT
Los cambios en las condiciones experimentales pueden alterar el balance y desplazar la posición de equilibrio para que se forme mayor o menor cantidad de producto deseado.
PRINCIPIOS DE LE CHATELIER
Ayuda a predecir en qué dirección se desplazará una reacción en equilibrio cuando hay un cambio de concentración, presión, volumen o temperatura.
Si se presenta una perturbación externa sobre un sistema en equilibrio, el sistema se ajustará de tal manera que se cancele parcialmente dicha perturbación en la medida que el sistema alcanza una nueva posición de equilibrio.
Ley de accione de masas
Para una reaccion reversible en equilibrio y a una temperatura constante, una relacion determinada de concentraciones de reactivos y productos tiene un valor constante K (la constante de equilibrio).
Es un proceso dinámico, que se alcanza cuando la rapideces de las reacciones en un sentido y en otro se igualan, y las concentraciones de los reactivos y productos permanecen constantes
LA CONSTANTE DE EQUILIBRO