jonka Yokasta Roman 4 vuotta sitten
1376
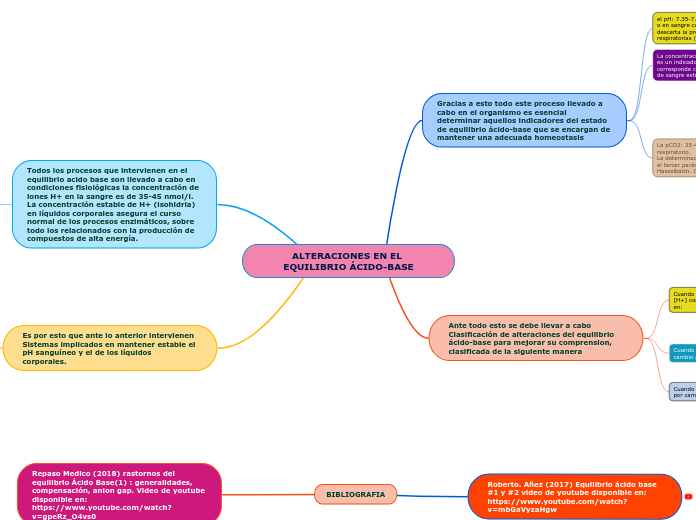
ALTERACIONES EN EL EQUILIBRIO ÁCIDO-BASE
El equilibrio ácido-base en el cuerpo humano es crucial para mantener condiciones fisiológicas que aseguren el correcto funcionamiento de los procesos enzimáticos, especialmente aquellos relacionados con la producción de compuestos de alta energía.