Química organica
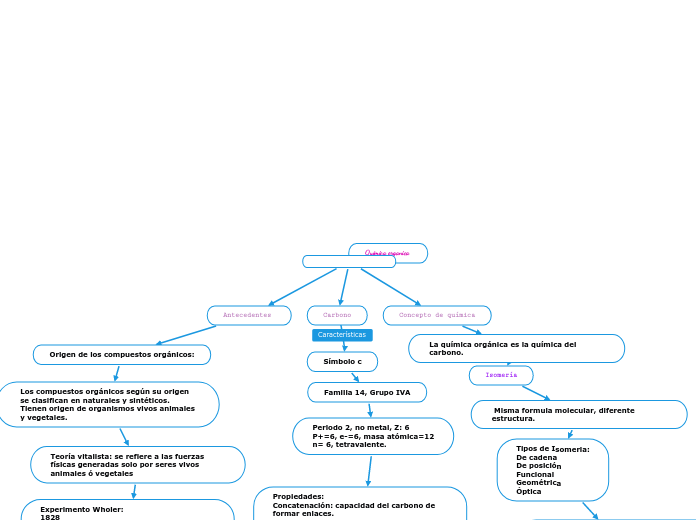
Química organica
Concepto de química
La química orgánica es la química del carbono.
Isomería
Misma formula molecular, diferente estructura.
Tipos de Isomeria:
De cadena
De posición
Funcional
Geométrica
Óptica
El grupo funcional es un átomo o conjunto de átomos unidos a una cadena carbonada, representada en la fórmula general por R para los compuestos alifáticos y como Ar compuestos aromáticos.
Carbono
Símbolo c
Familia 14, Grupo IVA
Periodo 2, no metal, Z: 6
P+=6, e-=6, masa atómica=12
n= 6, tetravalente.
Propiedades:
Concatenación: capacidad del carbono de formar enlaces.
Isomeria: misma formula molecular, diferente estructura.
Alotropia: Característica de ciertos elementos que pueden aparecer en más de una forma con distintas propiedades físicas y químicas.
Hibridación: cuando en un átomo, se mezcla el orden de los electrones entre orbitales creando una configuración electrónica nueva.
Tipos de formulas:
Desarrollada
Semidesarrollada
Molecular o condensada
Taquigrafica o línea y punto
Tipos de carbono
Átomo de carbono primario: un átomo de carbono vecino. Átomo de carbono secundario: dos átomos de carbono vecinos. Átomo de carbono terciario: tres átomos de carbono vecinos.
Tipos de esqueletos
Cadena abierta (ariciclica) , cadena cerrada (cíclica)
Antecedentes
Origen de los compuestos orgánicos:
Los compuestos orgánicos según su origen se clasifican en naturales y sintéticos. Tienen origen de organismos vivos animales y vegetales.
Teoría vitalista: se refiere a las fuerzas físicas generadas solo por seres vivos animales ó vegetales
Experimento Wholer:
1828
Un compuesto inorganico qué reaccionó al calor y
dio lugar a un compuesto orgánico. (cianato de amonio
y urea.
Compuestos inorgánicos
Están constituidos por todas las
combinaciones posibles de elementos
Se conocen 500,000 compuestos
Solubles en agua o solventes polares
Tienen enlaces ionicos
Su estado es sólido
Tienen una reacción estable con el acido
sulfúrico
Estables térmicamente, fusion y ebullición
con puntos altos
Compuestos orgánicos.
Se componen de CHONPS
sus compuestos rebasan los 13 millones
Tienen moleculas con enlace Covalente
Solubles en solventes no polares
No conducen electricidad
Sus estados de agregación son solido, líquido y gaseoso
Reaccionan enérgicamente con el ácido sulfúrico
Inestables con el calor, puntos de fusión y ebullición bajos.