jonka miguel marquez 4 vuotta sitten
224
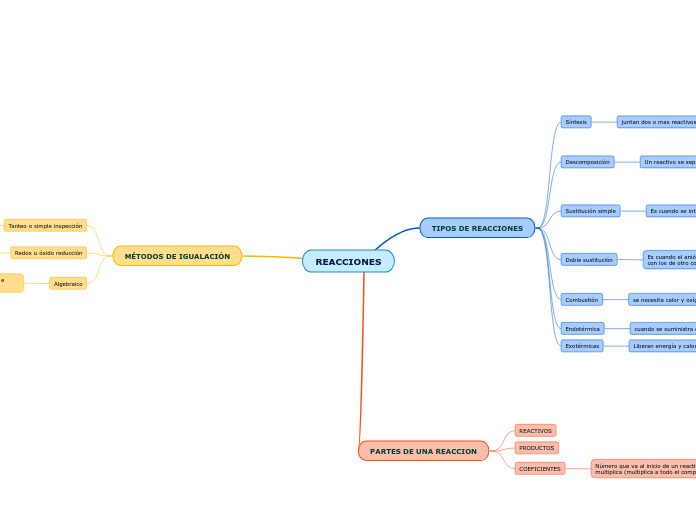
REACCIONES
En las reacciones químicas, los reactivos se transforman en productos mediante diferentes tipos de interacciones. Los coeficientes juegan un papel esencial al multiplicar compuestos enteros para equilibrar las ecuaciones.