T·v = 1 => T = 1/v i v = 1/T
v = λ/T => λ = v·T = v/v => v = v/λ
v = λ·v
CONCEPTES BÀSICS D'ONDULATÒRIA
Espectres atòmics
Exemple: Als focs artificials es poden veure diferents colors de la flama.
Explicació:
1. Els electrons dels àtoms de les substàncies pirotècniques adquireixen energia en escalfar-se per l'acció de les combustions (els electrons dels àtoms s'exciten)
2. En refredar-se, perden l'excés d'energia per tornar al seu estat inicial
3. Aquest excés d'energia és alliberat en forma de radiació d'una determinada longitud d'ona (d'una zona concreta de l'espectre)
4. Si aquesta zona és invisible, observarem coloració a la flama
Classificació
Segons el tipus de causa que els origina:
Espectres d'absorció
Són els que provenen de la font emissora, però que han travessat una matèria determinada.
Espectres d'emissió
Són els que provenen directament de la font emissora.
Segons les radiacions que continguin:
Espectres discontinus
Són els que només contenen certes radiacions de determinades longituds d'ona.
Espectres continus
Són els que abasten totes les radiacions compreses entre dos extrems, passant de les unes a les altres gradualment.
Definició espectre
La descomposició de qualsevol radiació electromagnètica en les radiacions de diferent longitud d'ona que la constitueix.
Mecànica ondulatòria
Període (T): el temps que triga una ona a recórrer una distància igual a la de la longitud d'ona. Es mesura en segons.
Freqüencia (v): el nombre de longituds d'ona que passen per un punt determinat en un segon. S'expressa en hertz (Hz) o s-1.
Longitud d'ona (λ): distància mínima entre dos punts amb el mateix estat de vibració.
Les més utilitzades són:
1µm = 10-6
1nm = 10-9
1A = 10-10
1pm = 10-12
Ones electromagnètiques: la forma que adopta l'energia electromagnètica quan es propaga.
TEORIES ATÒMIQUES
Bohr
(1913)
Els tres postulats es refereixen a l'electró:
El model de l'àtom de Rutherford ja deixava clara la part referida al nucli.
3r postulat. Els electrons poden canviar d'una òrbitra a una altra absorbint o emetent energia.
- Si passa d'una òrbita inferior a una superior, l'electró absorbeix energia.
- Si passa d'una òrbita superior a una inferior, l'electró emet energia.
L'enegia ve deguda per l'equació de Planck:
Ef = E2 - E1 = h·v
2n postulat. Les òrbites permeses són aquelles en les que el moment angular de l'electró és múltiple de "h".
me·v2·R = n·(h/2π)
Rn = n2·h2/4π2·K·Z·e2·me
1r postulat. L'electró gira al voltant del nucli sense emetre energia.
La força centrípeta = interacció electrostàtica
m·v2 /R = k·Z·e2 /R2
R = K·Z·e2/m·v2
Rutherford
(1911)
Model nuclear:
- La massa dels àtoms està pràcticament concentrada en el nucli.
- La càrrega positiva també radica en el nucli.
- Els electrons circulen en òrbies circulars al voltant del nucli.
- La major part de l'àtom és un gran espai buit.
Experiment (làmina d'or):
Substància radiactiva que es descomponia en partícules alpha, passat per un colimador per obtenir un raig. Els rajos els feien xocar contra una làmina d'or molt fina.
Si el model de Thomson era bo, les partícules havien de travessar la làmina d'or.
RESULTAT: La majoria de les partícules travessaven la làmina d'or però algunes rebotaven contra ella.
Nagaoka
(1904)
Model saturnià:
L'àtom era un conjunt d'electrons que giraven al voltant d'un cos central positiu, igual que els anells al voltant de Saturn.
J. J. Thomson
(1903)
Model de pudin de panses:
Experiment (fluorescent):
- La càrrega dels rajos era inherent i no es podien separar.
- La càrrega dels rajos era negativa.
- La relació entre la massa i la càrrega de les partícules que formaven els rajos.
L'atom és una esfera amb càrrega elèctrica positiva i els electrons estaven encastats.
Experiment (fluorescent):
1. La càrrega dels rajos era inherent i no es podien separar.
2. La càrrega dels rajos era negativa.
3. La relació entre la massa i la càrrega de les partícules que formaven els rajos.
Kelvin
(1902)
L'atom era una esfera carregada positivament i els electrons estaven incrustats en l'esfera com si fossin llavors d'una síndria.
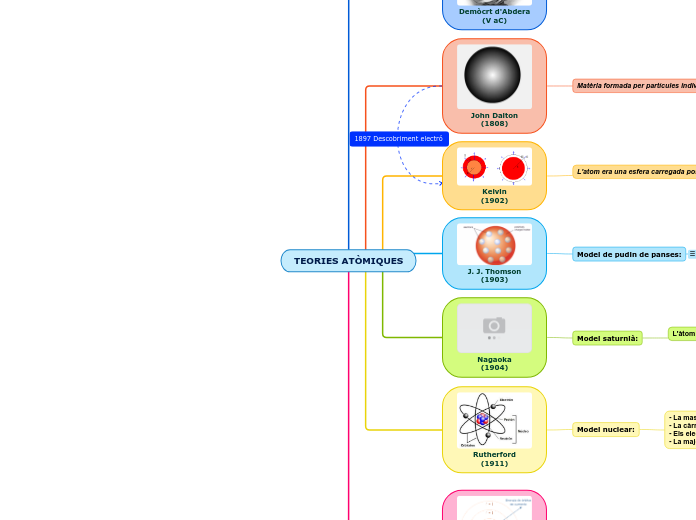
John Dalton
(1808)
Matèria formada per partícules indivisibles i indestructibles anomenades àtoms.
Àtoms:
d'un mateix element són idèntics entre sí en massa i propietats.
de diferents elements varien en massa i propietats.
Compostos: Substàncies que es formen en combinar àtoms d'elements diferents en proporcions simples.
Demòcrt d'Abdera
(V aC)
L'interior de la matèria conté unes partícules anomenades àtoms.
Àtom:
Indivisible
Forma variable segons la substància