Le soluzioni
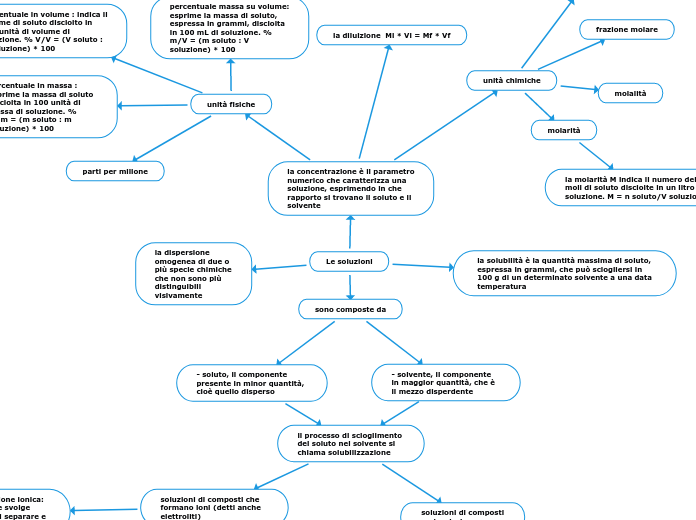
la concentrazione è il parametro numerico che caratterizza una soluzione, esprimendo in che rapporto si trovano il soluto e il solvente
la diluizione Mi * Vi = Mf * Vf
unità chimiche
normalità
frazione molare
molalità
molarità
la molarità M indica il numero delle moli di soluto disciolte in un litro di soluzione. M = n soluto/V soluzione
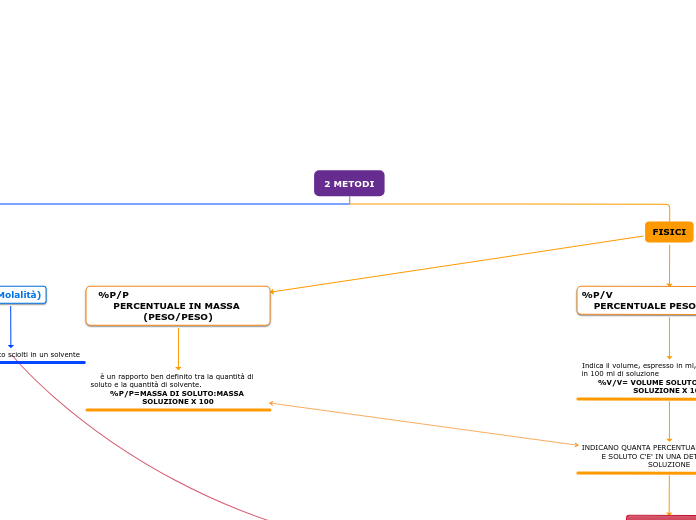
unità fisiche
percentuale massa su volume: esprime la massa di soluto, espressa in grammi, disciolta in 100 mL di soluzione. % m/V = (m soluto : V soluzione) * 100
percentuale in volume : indica il volume di soluto disciolto in 100 unità di volume di soluzione. % V/V = (V soluto : V soluzione) * 100
percentuale in massa : esprime la massa di soluto disciolta in 100 unità di massa di soluzione. % m/m = (m soluto : m soluzione) * 100
parti per milione
la solubilità è la quantità massima di soluto, espressa in grammi, che può sciogliersi in 100 g di un determinato solvente a una data temperatura
la dispersione omogenea di due o più specie chimiche che non sono più distinguibili visivamente
sono composte da
- soluto, il componente presente in minor quantità, cioè quello disperso
il processo di scioglimento del soluto nel solvente si chiama solubilizzazione
soluzioni di composti molecolari
soluzioni di composti che formano ioni (detti anche elettroliti)
elettroliti forti e deboli
la formazione di ioni può avere luogo anche con soluti costituiti da molecole polari
la solubilizzazione avviene quando si instaura un'attrazione di tipo elettrostatico tra gli ioni positivi (cationi) e la parte terminale negativa delle molecole d'acqua e tra gli ioni negativi (anioni) e la parte terminale positiva delle molecole d'acqua
a queste forze attrattive viene dato il nome di legami ione - dipolo
Dissociazione ionica: il solvente svolge l'azione di separare e disperdere i ioni
- solvente, il componente in maggior quantità, che è il mezzo disperdente