jonka MODAFFARI LEO 4 vuotta sitten
321
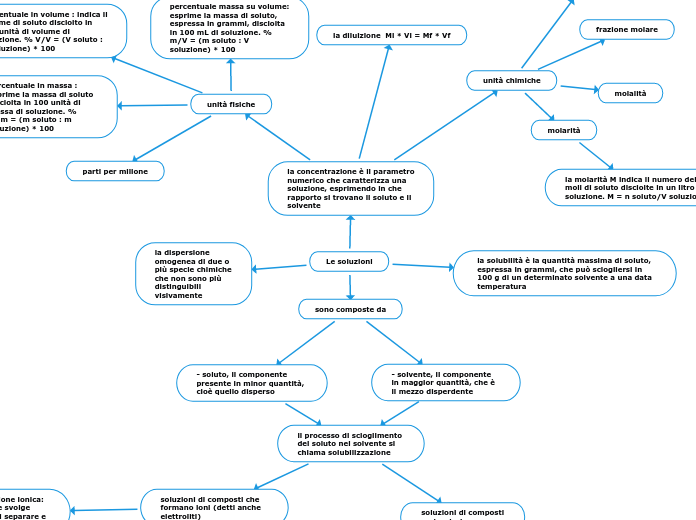
Le soluzioni
Le soluzioni sono miscele omogenee costituite da un solvente e uno o più soluti. Il solvente è presente in quantità maggiore, mentre il soluto è disperso nel solvente. Il processo con cui il soluto si dissolve nel solvente è chiamato solubilizzazione, e può coinvolgere la formazione di ioni in soluzioni elettrolitiche.