par ALBURQUEQUE CUENTAS Valeria Alejandra Il y a 2 années
324
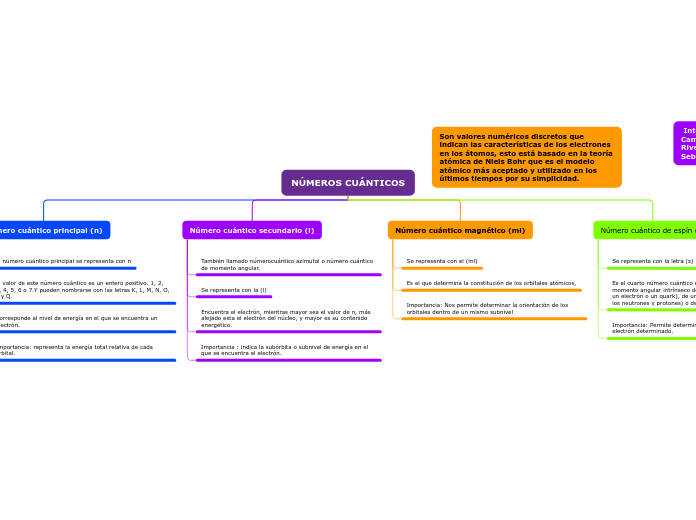
NÚMEROS CUÁNTICOS
Los números cuánticos son valores numéricos discretos que describen las características de los electrones en los átomos según la teoría atómica de Niels Bohr. El número cuántico principal (