par MARLENE ILEANA RAMIREZ CERVERA Il y a 4 années
398
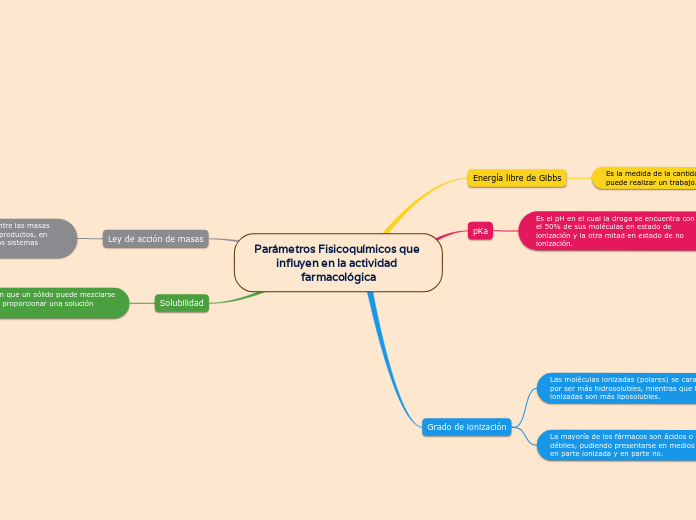
Parámetros Fisicoquímicos que influyen en la actividad farmacológica
En el estudio de la actividad farmacológica, los parámetros fisicoquímicos desempeñan un papel crucial. La ley de acción de masas establece que la velocidad de una reacción química es proporcional al producto de las concentraciones de las especies reaccionantes.