par Gisbel Velez Velez Il y a 4 années
462
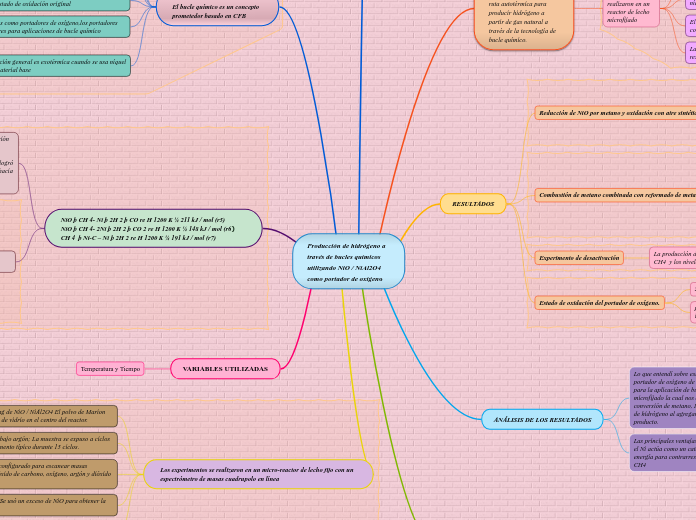
Producción de hidrógeno a través de bucles químicos utilizando NiO / NiAl2O4 como portador de oxígeno
par Gisbel Velez Velez Il y a 4 années
462

Plus de détails