作者:Gisbel Velez Velez 4 年以前
463
Producción de hidrógeno a través de bucles químicos utilizando NiO / NiAl2O4 como portador de oxígeno
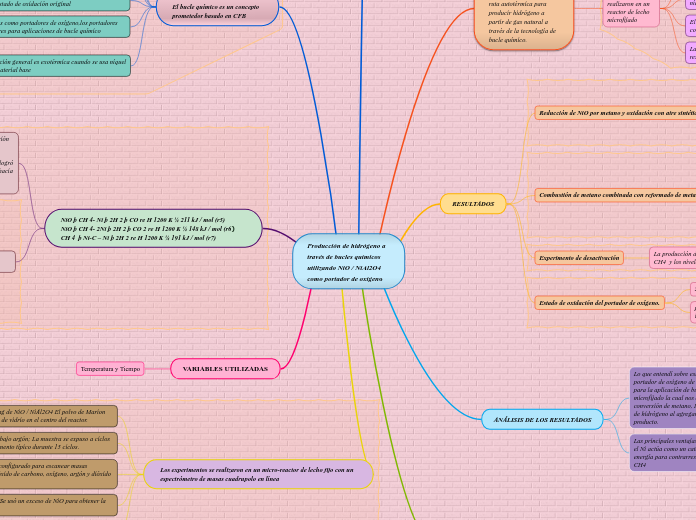
作者:Gisbel Velez Velez 4 年以前
463

更多类似内容