Química Orgánica:
Grupos Funcionales:
Halógenos:
R-X
X: Cualquier elemento perteneciente a los halogenos.
-X
Sal organica:
R-COO-M
-COO-M
Ester:
R-COO
-COO
Éter:
Grupo Funcional:
-O-
Formula General:
R-O-R
R: Cadena de carbonos.
Hidrocarburos:
Alquinos:
Enlace triple: C =- C
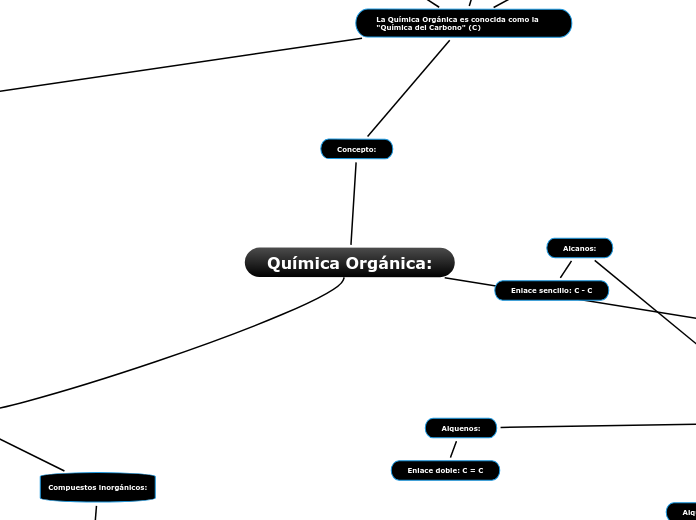
Alquenos:
Enlace doble: C = C
Alcanos:
Enlace sencillo: C - C
Tipos de compuestos:
Compuestos inorgánicos:
Formado por la combinación de los 109 elementos restantes en la tabla periódica, y son cerca de 500 mil compuestos.
Predominan los compuestos iónicos o bien compuestos de moléculas polares y conducen corriente eléctrica.
Estabilidad
Son solidos, mucho más resistentes al calor y acciones de agentes químicos. Se disuelven más fácilmente en agua que al ser más sencillas, tiene baja masa molecular y son reacciones muy rápidas.
Compuestos orgánicos:
Formado por los elementos (H, O, N, P, S, halógenos y metales) y son cerca de 13 Millones.
Enlaces:
Predominan los enlaces covalentes, los cuales al disolverse en solventes no polares, no conducen corriente eléctrica.
Estabilidad:
Son solidos, líquidos y gaseoso, muy inestables a la acción de los agentes fisicoquímicos (como el calor).
Concepto:
La Química Orgánica es conocida como la "Química del Carbono" (C)
Propiedades del carbono:
Hibridación:
Combinación de orbitales puros para formar nuevos orbitales llamados hibridos.
Alotropía:
Propiedad de los elementos en presentarse en el mismo estado de agregación y diferente estructura.
Isomería:
Tipos de isomería:
Isomería Geométrica:
La presencia de la doble ligadura entre dos átomos de carbono, genera las condiciones
Isomería Funcional:
Compuestos de igual fórmula molecular que presentan funciones químicas diferentes.
Isomería de Posición:
Los compuestos tienen las mismas funciones químicas, pero sobre átomos de carbono con números localizadores diferentes.
Isomería de Cadena:
Los compuestos tienen distribuidos los átomos de carbonos de la molecula de forma diferente.
Misma formula molecular y diferente estructura.
Concatenación:
Capacidad del átomo de carbono de unirse consigo mismo y formar distintos esquemas.
Tipos de esqueletos:
Cadena cerrada (cíclica):
Heterociclicos:
Cuando los ciclos presentan un átomo diferente al carbono.
Homociclicos:
Solo tiene átomos de carbono se clasifican en aromaticos (con benzeno) y en alicilicos (sin benzeno).
Cadena abierta (acíclicos):
Saturados:
Son flexibles y solidos a temperatura ambiente.
Insaturados:
Hay dobles o triples enlaces, rigidos y son liquidos aceitosos.
Tipos de carbono:
Carbono cuaternario:
Un átomo de carbono unido a cuatro átomos de carbono.
C - C - C - C - C
Carbono terciario:
Un átomo de carbono unido a tres átomos de carbono.
C - C - C - C
Carbono secundario:
Un átomo de carbono unido a dos átomos de carbono.
C - C - C
Carbono primario:
Un átomo de carbono unido a otro.
C - C
Caracteristicas del carbono:
No metal.
Es tetravalente: 4 enlaces.
Forma espacial: Tetraédrica.
Electrones de valencia: 4e
Periodo: 2
Nivel de energía: K, L
Grupo: IV A
Configuración electronica: 1s2, 2s2, 2p2.
Familia: 14
Número de mas atómica: 12.0107
Número de electrones (e): 6
Número de protones (p): 6
Número atómico (Z): 6
Símbolo en la tabla periodica: "C"