par JOSE FRANCISCO SIERRA ALCALA Il y a 3 années
188
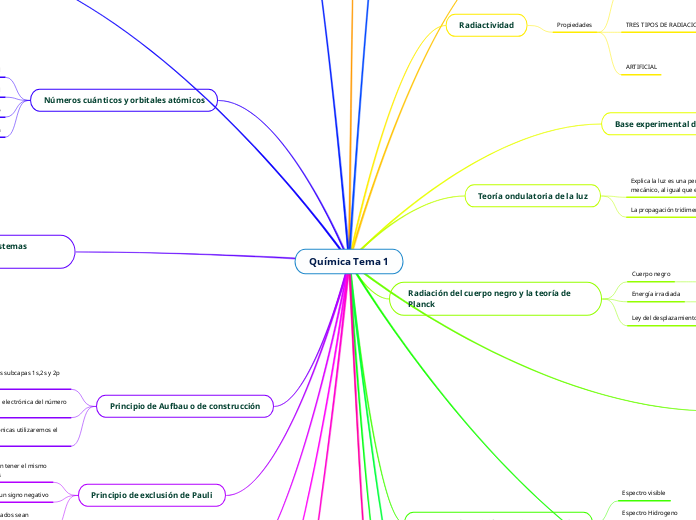
Química Tema 1
La teoría cuántica, fundamentada por Max Planck, describe las propiedades dinámicas de las partículas subatómicas y sostiene que no es posible determinar con precisión su posición. Esta teoría, junto con el principio de dualidad propuesto por Louis de Broglie, explica que la luz puede comportarse tanto como onda como partícula.