par Julio Cesar Lopez Nava Il y a 4 années
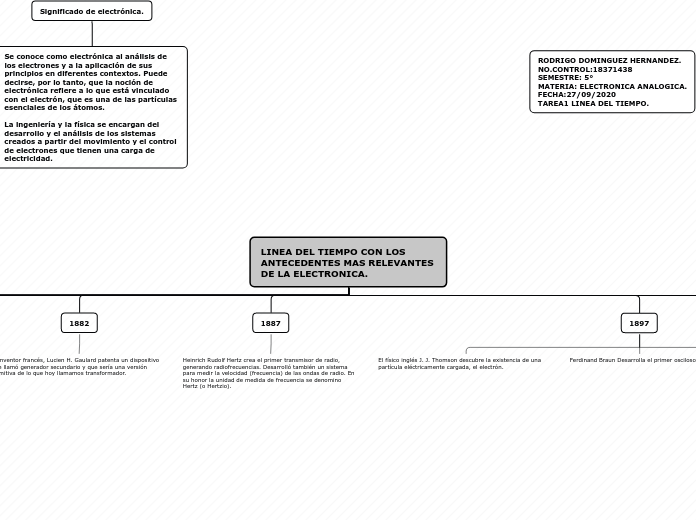
1697
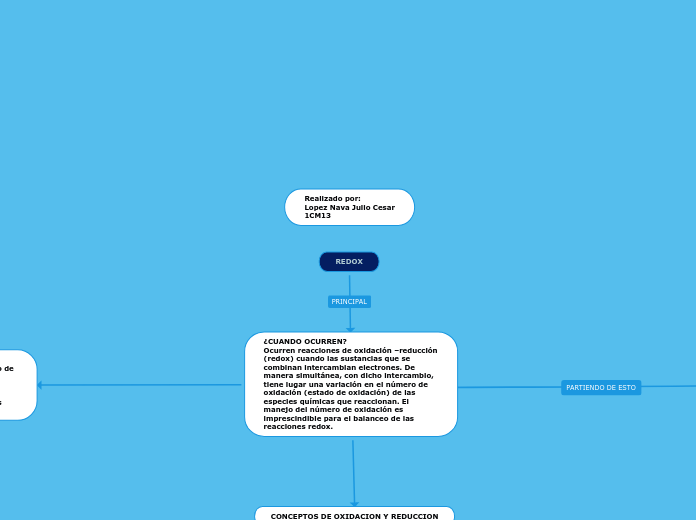
REDOX
El número de oxidación se refiere a la carga real o virtual de átomos, moléculas o iones en sustancias puras, y se determina con base en la electronegatividad. Las reglas específicas definen que el número de oxidación es positivo cuando el átomo pierde electrones o los comparte con un átomo que los atrae, y negativo cuando el átomo gana electrones o los comparte con un átomo que los cede.